Авторы
Малыгин А. С.
врач-клинический фармаколог1
Андреев С. С.
заведующий, отделение клинической фармакологии, врач-клинический фармаколог1
Царенко С. В.
д.м.н., профессор, факультет фундаментальной медицины2, анестезиолог-реаниматолог, заместитель главного врача по анестезиологии и реанимации1
Петрушин М. А.
врач-анестезиолог-реаниматолог, руководитель реанимационной службы3
1ГБУЗ «Городская клиническая больница №52» Департамента здравоохранения города Москвы, г. Москва, Российская Федерация
2ФГБОУ ВО «Московский государственный университет имени М. В. Ломоносова», г. Москва, Российская Федерация
3ГБУЗ «Тверская областная клиническая больница», г. Тверь, Российская Федерация
Автор для корреспонденции
Малыгин Александр Сергеевич; e-mail: dr.a.s.m@yandex.ru
Финансирование
Исследование не имело спонсорской поддержки.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Аннотация
Проведен ретроспективный анализ историй болезни и результатов микробиологического исследования крови пациентов с коронавирусной инфекцией COVID-19, проходивших лечение в инфекционном госпитале городской клинической больницы № 52 города Москвы в 2020 году. Для каждого изолята Klebsiella pneumoniae определена чувствительность к основным антибактериальным средствам, охарактеризован фенотип возбудителя (MDR, XDR, PDR). Результаты исследования обработаны статистически и оформлены в виде реестра случаев бактериемии. Большинство изолятов патогенов (79%) было выделено из крови пациентов, находившихся в отделениях реанимации и интенсивной терапии. В структуре бактериемии Klebsiella pneumoniae занимала первое место, частота встречаемости патогена составила 41,1% (282/686). Чувствительными к антибиотикам были только 4% изолятов Klebsiella pneumoniae, встречаемость антибиотикорезистентных штаммов по фенотипу составила MDR – 16%, XDR – 76%, PDR – 4%. Большинство выделенных штаммов Klebsiella pneumoniae были карбапенем-резистентными (85,4%), 11,1% – колистин-резистентными, 10,6% изолятов были продуцентами β-лактамаз расширенного спектра.
Ключевые слова
бактериемия, антибиотикорезистеность, Klebsiella pneumoniae, COVID-19
Для цитирования
Малыгин А. С., Андреев С. С., Царенко С. В., Петрушин М. А. Антибиотикорезистентность изолятов Klebsiella pneumoniae, выделенных из крови больных COVID-19. Медицина 2021; 9(2): 63-74.
DOI
Введение
Бактериальные и грибковые инфекции являются наиболее частыми осложнениями вирусных пневмоний. Пациенты с тяжелым течением COVID-19, длительным пребыванием в отделениях реанимации и интенсивной терапии (ОРИТ) подвержены высокому риску развития вторичных инфекций, вызванных патогенами с множественной лекарственной устойчивостью [1-2]. Оценка риска инфицирования полирезистентными микроорганизмами необходима для принятия решения о своевременной и эффективной эмпирической антибактериальной терапии [3].
Распространение энтеробактерий с множественной лекарственной устойчивостью (МЛУ) представляет глобальную угрозу для здравоохранения ввиду узкого спектра терапевтических опций [4] и повышенной ассоциацией с неблагоприятными клиническими исходами [5]. Предпосылками для возникновения штаммов с МЛУ послужило широкое применение цефалоспоринов и фторхинолонов, что привело к появлению энтеробактерий, продуцирующх β-лактамазы расширенного спектра (БЛРС) [6]. Увеличение частоты использования карбапенемов стимулировало распространение карбапенем-резистентных энтеробактерий (англ. carbapenem-resistant Enterobacteriaceae, CRE) [7]. Появление микроорганизмов, обладающих геном mcr, привело к формированию устойчивости к полимиксинам [8-9], что представляет глобальную угрозу для здравоохранения ввиду потери возможности лечения инфекций, вызванных CRE [10].
Механизмы резистентности энтеробактерий к карбапенемам включают гиперпродукцию хромосомных β-лактамаз Amp C или БЛРС в сочетании с нарушением проницаемости клеточной стенки, потерей пориновых каналов, а также ферментативную инактивацию антибиотика за счет продукции карбапенемаз [11]. Наиболее распространенный возбудитель гнойно-септических осложнений из семейства энтеробактерий, Klebsiella pneumoniae, является "коллектором" генов антибиотикорезистентности [12], продуцентом множества карбапенемаз, в частности ОХА‑48, NDM‑1, KPC, VIM типов [13]. Бактериемии, вызванные устойчивыми к карбапенемам изолятами, ассоциированы с высокой летальностью [14-17].
Профиль резистентности энтеробактерий вариабелен в зависимости от региона и стационара. Осуществление локального микробиологического мониторинга необходимо для своевременной разработки и коррекции протоколов антибактериальной терапии [18].
Цель исследования
Цель исследования – оценить антибиотикорезистентность изолятов Klebsiella pneumoniae, выделенных из крови пациентов с COVID-19, находящихся на лечении в инфекционном госпитале.
Материалы и методы исследования
Проведен ретроспективный анализ историй болезни и результатов микробиологического исследования крови пациентов с COVID-19, проходивших лечение в инфекционном госпитале городской клинической больницы №52 города Москвы в 2020 году. Диагноз коронавирусной инфекции был подтвержден результатами ПЦР РНК SARS-CoV-2 назофарингиального мазка. У всех включенных в исследование пациентов имелись признаки вторичной бактериальной инфекции и в крови была обнаружена Klebsiella pneumoniae. В работе проанализирована частота клебсиеллезной бактериемии. Исследована структура назначений антибактериальных средств эмпирической и этиотропной терапии.
Для всех изолятов Klebsiella pneumoniae, выделенных из крови больных COVID-19 была проведена оценка антибиотикорезистетности. Идентификацию возбудителей проводили с использованием MALDI-TOF масс-спектрометра и программно-аппаратного комплекса MALDI Biotyper (Bruker Daltonics, Германия). Чувствительность к антибиотикам исследовали на автоматическом бактериологическом анализаторе Phoenix-100 (Becton Dickinson, США) в соответствии с ГОСТ Р ИСО 20776-1-2010 [19] и протоколом клинических лабораторных стандартов [20]. Минимальную подавляющую концентрацию (МПК) определяли [21] для следующих антибактериальных средств: цефалоспорины (цефотаксим, цефепим, цефтазидим), аминогликозиды (гентамицин, амикацин), карбапенемы (имипенем, меропенем), полимиксины (колистин), антибиотики разных групп (азтреонам, фосфомицин, тигециклин), сульфаниламиды (ко-тримоксазол), фторхинолоны (левофлоксацин). Для приготовления рабочих растворов использовали субстанции антибактериальных средств (Molekula GmbH; Германия). Способность Klebsiella pneumoniae продуцировать β-лактамазы расширенного действия (БЛРС) определяли согласно протоколу [20].
По результатам исследования бактериальные штаммы подразделяли на чувствительные (S – susceptible), промежуточной (умеренной) чувствительности (I – intermediate) и резистентные (R – resistant). В зависимости от выраженности антибиотикорезистентности определяли фенотипы изолятов Klebsiella pneumoniae: MDR (англ. multidrug resistant – мультирезистентные), XDR (анг. extremely drug resistant – экстремально резистентные) и PDR (англ. pan drug resistant – панрезистентные). Статистическую обработку данных осуществляли с помощью программы "BioStat, 2009" (AnalystSoft; США).
Результаты исследования и их обсуждение
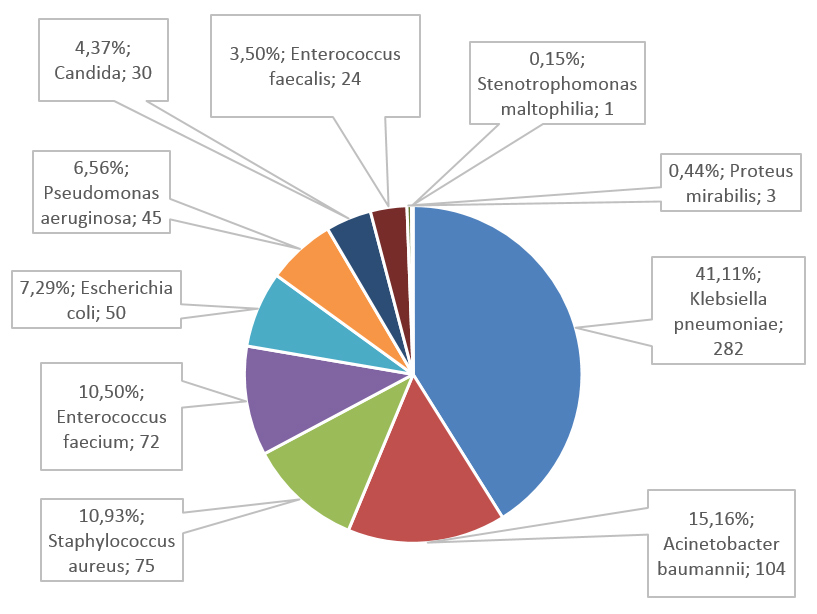
Микроорганизмы были обнаружены в образцах крови 520 больных коронавирусной инфекцией COVID-19 (средний возраст 62,6±15,6 лет; мужчин – 58,9%, женщин – 41,1%). Всего было выделено 686 штаммов патогенов. Большинство изолятов 79% (539/686) было выделено из крови пациентов, находившихся в ОРИТ. Доля грамотрицательных бактерий составила 70,6% (485/686); грамположительных бактерий – 24,9% (171/686), микромицетов – 4,3% (30/686). Наиболее часто встречались следующие патогены: Klebsiella pneumoniae – 41,1% (n=282); Acinetobacter baumannii – 15,6% (n=104); Staphylococcus aureus – 10,9% (n=75); Enterococcus faecium – 10,5% (n=72); Escherichia coli – 7,29% (n=50). Частота обнаружения Pseudomonas aeruginosa составила 6,7% (n=45), грибы рода Candida были обнаружены в 4,3% случаев (n=30). Реже встречались Enterococcus faecalis – 24 изолята (3,5%); Proteus mirabilis – 3 изолята (0,4%) и Stenotrophomonas maltophilia – 1 изолят. Структура возбудителей бактериемий пациентов с COVID-19 представлена на рисунке 1.
Рис. 1. Структура возбудителей бактериемии у пациентов с COVID-19
Ассоциации бактериальных возбудителей были выявлены у 10,9% пациентов с бактериемией (n=57). Превалировали ассоциации граммотрицательных микроорганизмов: Klebsiella pneumoniae + Acinetobacter baumannii – 38,6% (n=22), Klebsiella pneumoniae + Pseudomonas aeruginosa – 8,77% (n=5), Klebsiella pneumoniae + Escherichia coli – 8,77%% (n=5). Реже встречались ассоциации с граммположительными патогенами: Enterococcus faecium + Klebsiella pneumoniae – 8,77% (n=6), Enterococcus faecium + Acinetobacter baumannii – 7,02% (n=4).
Структура микробных ассоциаций в крови пациентов с COVID-19 представлена на рисунке 2.
Рис. 2. Структура микробных ассоциаций в крови пациентов с COVID-19.
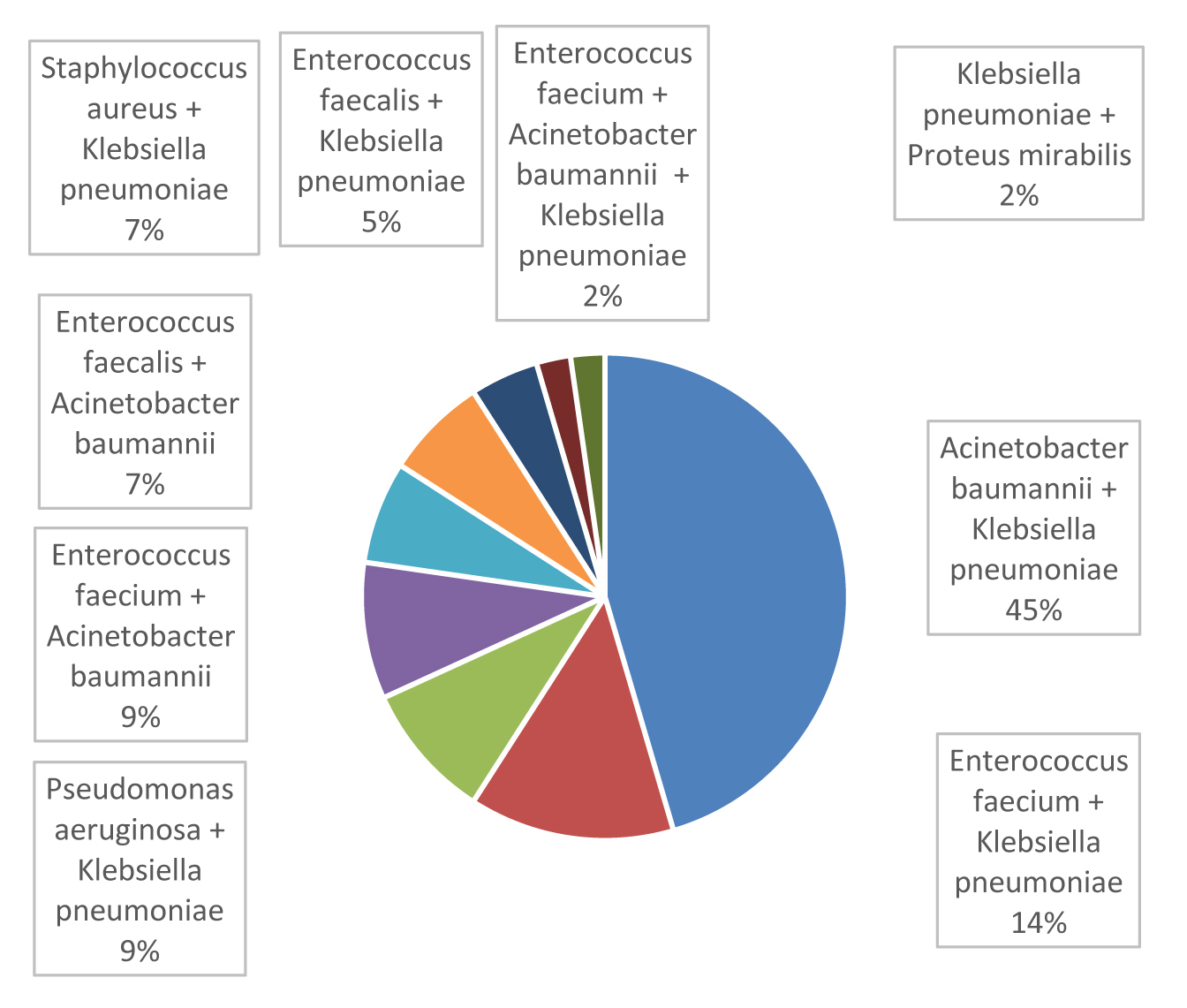
Приведенные данные свидетельствуют о том, что в структуре нозокомиальной бактериемии превалируют Klebsiella рneumoniae и ее ассоциации с другими патогенами.
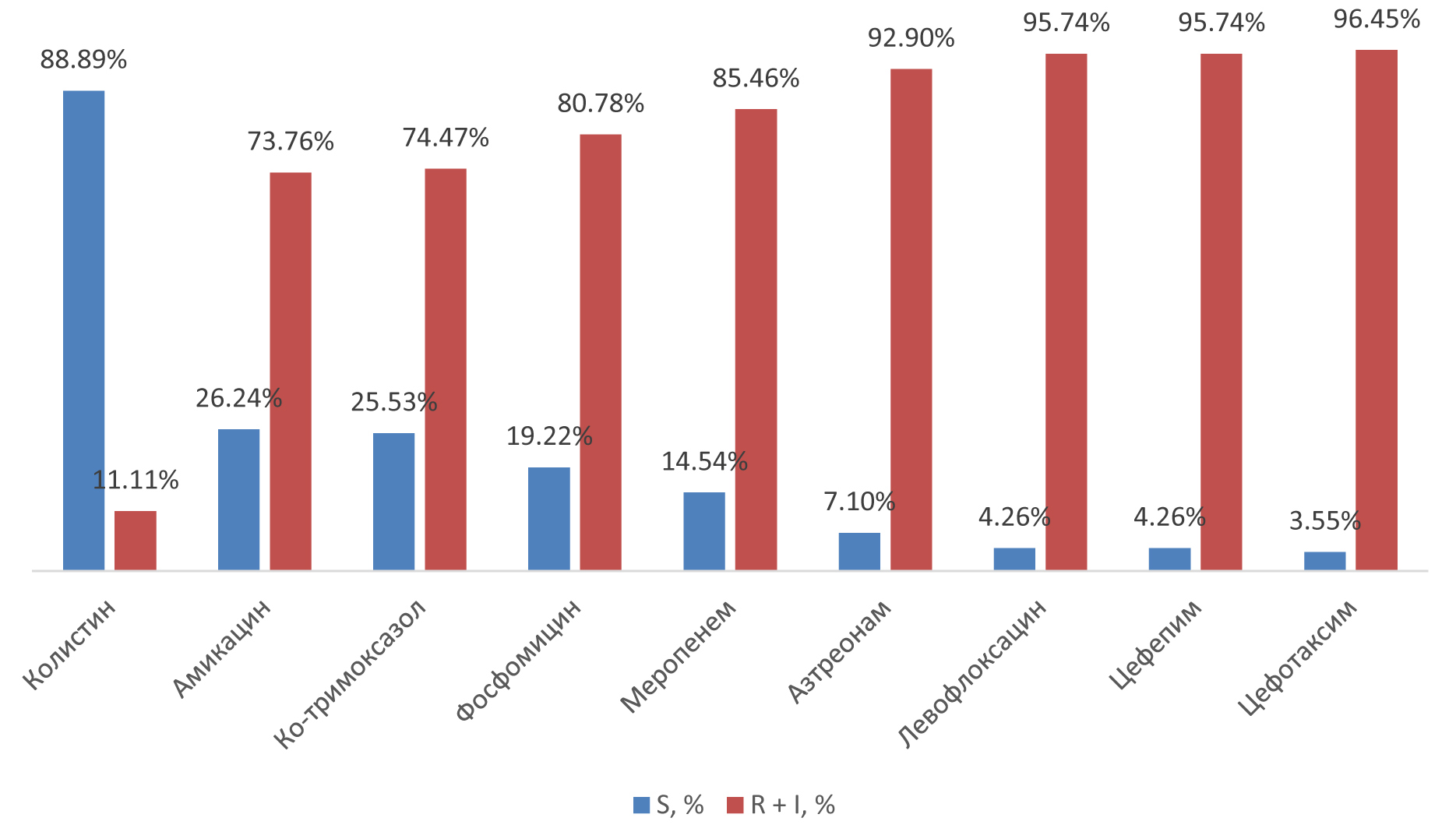
Чувствительными к основным антибактериальным средствам были только около 4% изолятов Klebsiella pneumoniae, большинство выделенных изолятов были нечувствительны к цефалоспоринам, карбапенемам, фторхинолонам, аминогликозидам, азтреонаму, ко-тримаксазолу, панрезистентные штаммы встречались в 4%. Чувствительность изолятов Klebsiella рneumoniae к колистину – антибиотику из группы полимиксинов составляла в среднем 88,9%.
Результаты оценки чувствительности и резистентности изолятов Klebsiella рneumoniae к основным антибактериальным средствам приведены в таблице 1 и на рисунке 3.
Таблица 1. Чувствительность изолятов Klebsiella Pneumoniae к основным антибактериальным средствам
| Антибактериальное средство | S | S, % | R + I | R + I, % | N |
| Колистин | 200 | 88,89% | 25 | 11,11% | 225 |
| Амикацин | 74 | 26,24% | 208 | 73,76% | 282 |
| Ко-тримоксазол | 72 | 25,53% | 210 | 74,47% | 282 |
| Фосфомицин | 49 | 19,22% | 206 | 80,78% | 255 |
| Меропенем | 41 | 14,54% | 241 | 85,46% | 282 |
| Азтреонам | 13 | 7,10% | 170 | 92,90% | 183 |
| Левофлоксацин | 12 | 4,26% | 270 | 95,74% | 282 |
| Цефепим | 12 | 4,26% | 270 | 95,74% | 282 |
| Цефотаксим | 10 | 3,55% | 272 | 96,45% | 282 |
Примечание: здесь и далее S – чувствительный, R – резистентный, I – промежуточная чувствительность, N – число изолятов, к которым была определена чувствительность
Рис. 3. Характеристика чувствительности изолятов Klebsiella Pneumoniae к основным антибактериальным средствам
Было отмечено, что среди исследованных изолятов Klebsiella pneumoniae распространенность продуцентов карбапенемаз составила 85,5% (241/282), частота БЛРС-продуцентов – 10,6% (30/282).
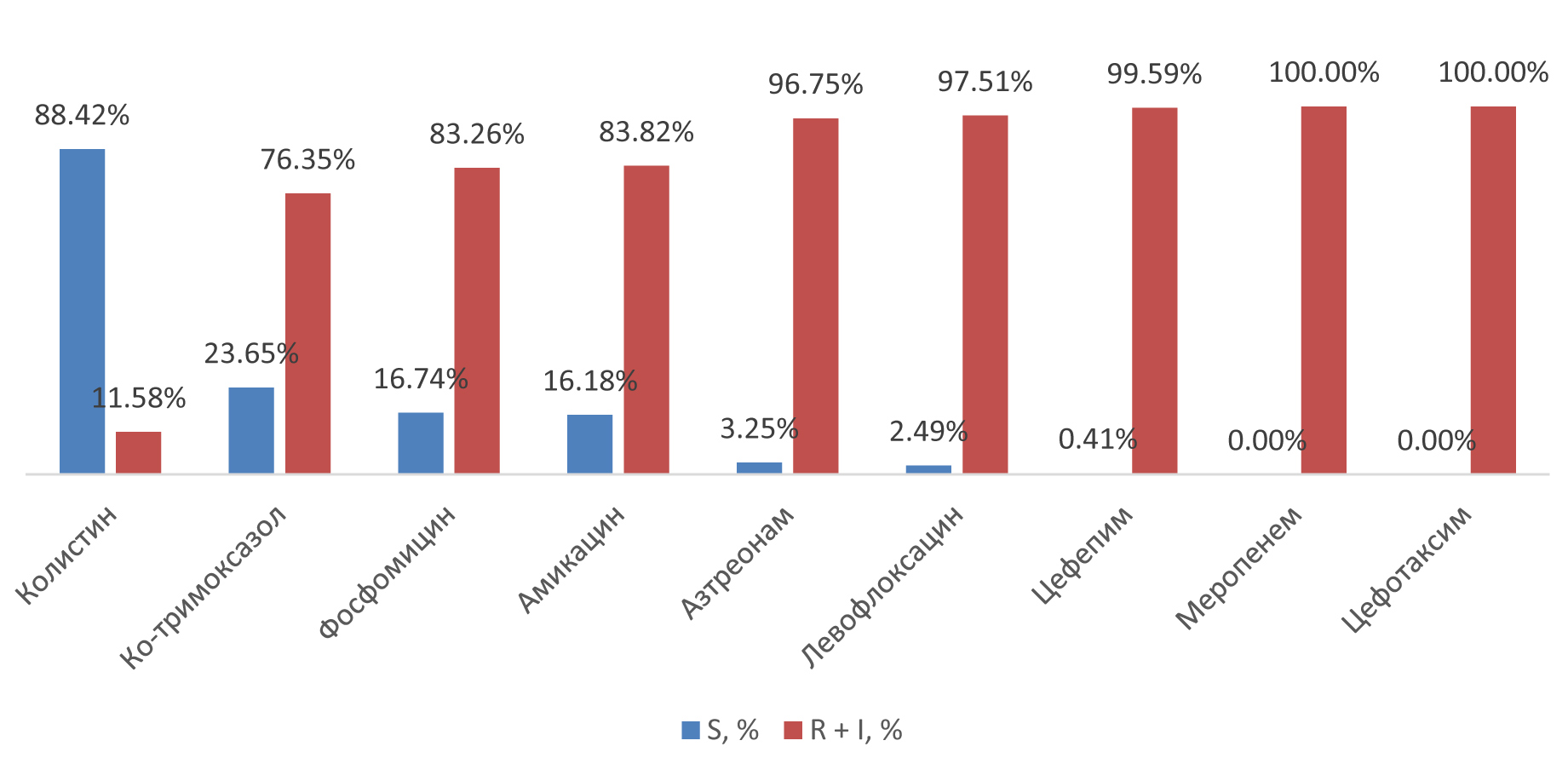
Большинство карбапенем-резистентных изолятов Klebsiella pneumoniae – 87,5% (211/241) было выделено от пациентов, проходивших лечение в ОРИТ. В отношении карбапенем-резистентных изолятов Klebsiella pneumoniae наибольшую активность проявили колистин – 88.4% (168/190), ко-тримоксазол – 23,6% (57/241), фосфомицин – 16,7% (37/184), амикацин – 16,1% (39/241) (табл. 2 и рис. 4).
Таблица 2. Характеристика чувствительности к антибактериальным средствам изолятов Klebsiella pneumoniae, продуцирующих карбапенемазы
| АМП | S | S, % | R + I | R + I, % | N |
| Колистин | 168 | 88,42% | 22 | 11,58% | 190 |
| Ко-тримоксазол | 57 | 23,65% | 184 | 76,35% | 241 |
| Фосфомицин | 37 | 16,74% | 184 | 83,26% | 221 |
| Амикацин | 39 | 16,18% | 202 | 83,82% | 241 |
| Азтреонам | 5 | 3,25% | 149 | 96,75% | 154 |
| Левофлоксацин | 6 | 2,49% | 235 | 97,51% | 241 |
| Цефепим | 1 | 0,41% | 240 | 99,59% | 241 |
| Цефотаксим | 0 | 0,00% | 241 | 100,00% | 241 |
Рис. 4. Характеристика чувствительности к антибактериальным средствам изолятов Klebsiella Pneumoniae, продуцирующих карбапенемазы
Распределение антибиотикорезистентных штаммов Klebsiella pneumoniae по фенотипу составила MDR – 16%, XDR – 76%, PDR – 4%. Приведенные данные свидетельствуют о том, что большинство изолятов Klebsiella Pneumoniae из крови больных COVID-19 были экстремально или множественно резистентными, что требует особого подхода к антибиотикотерапии при бактериемии.
Анализ структуры использования антибактериальных средств показал, что при клебсиеллезной бактериемии наиболее часто были использованы 2,3-компонентные схемы, включающие ингибитор-защищенные пенициллины (пиперациллин/тазобактам, амоксициллин/сульбактам), ингибитор-защищенные цефалоспорины (цефтазидим/авибактам, цефепим/сульбактам), карбапенемы (имипенем/циластатин, меропенем, дорипенем, эртапенем), аминогликозиды (амикацин, гентамицин), полимиксины (полимиксин В, колистин), фосфомицин, ко-тримоксазол, рифампицин (табл. 3).
Таблица 3. Наиболее часто применяемые схемы антибактериальной терапии бактериемии Kl. pneumoniae
| Схема терапии | % |
| Пиперациллин/тазобактам + аминогликозид | 14,5 % |
| Цефепим/сульбактам + аминогликозид | 11,4 % |
| Цефепим/сульбактам + аминогликозид + полимиксин В | 6,2 % |
| Цефоперазон/сульбактам + аминогликозид | 5,2 % |
| Карбапенем + аминогликозид | 5,2 % |
| Цефепим/сульбактам + полимиксин В | 4,1 % |
| Цефоперазон/сульбактам + полимиксин В + колистин (ингаляционно) | 3,1 % |
| Цефепим/сульбактам + полимиксин В + колистин (ингаляционно) | 3,1 % |
| Пиперациллин/тазобактам + АГ + полимиксин В | 3,1 % |
| Цефоперазон/сульбактам + полимиксин В | 2 % |
| Цефтазидим/авибактам + полимиксин В + колистин (ингаляционно) | 2% |
Примечание: аминогликозид – амикацин или гентамицин, карбапенем – меропенем или дорипенем или эртапенем или имипенем/циластатин
Учитывая, что пандемия COVID-19 привела к глобальному росту и распространению энтеробактерий (в том числе Klebsiella pneumoniae) с фенотипом экстремальной резистентности, в лечении вторичных бактериальных осложнений, вызванных данными патогенами, необходимо использовать комбинированные схемы антибиотикотерапии с учетом результатов микробиологического контроля. Возможные схемы лечения бактериемии, вызванной карбапенем-резистентной Klebsiella pneumoniae, составляют: ингибитор-защищенные цефалоспорины или карбапенемы + аминогликозид + полимиксин В + ингаляционный колистин (или без колистина). В условиях широкого распространения в инфекционных стационарах и особенно ОРИТ карбапенем-резистентных штаммов Klebsiella pneumoniae и отсутствия надежных схем терапии бактериемии необходимым является осуществление строгих мер инфекционного контроля.
Выводы
1. В структуре бактериемий у пациентов с COVID-19 преобладают Klebsiella pneumoniae и ее ассоциации с другими патогенами.
2. Большинство карбапенем-резистентных изолятов Klebsiella pneumoniae (87,5%) было выделено из крови пациентов, проходивших лечение в ОРИТ.
3. Чувствительными к антибиотикам были только 4% изолятов Klebsiella pneumoniae, большинство выделенных штаммов Klebsiella pneumoniae были карбапенем-резистентными (85,4%), 11,1% – колистин-резистентными, 10,6% изолятов были продуцентами β-лактамаз расширенного спектра. Распространенность антибиотикорезистентных штаммов по фенотипу составила MDR – 16%, XDR – 76%, PDR – 4%.
Список литературы
1. Giacobbe D.R., Battaglini D., Ball L., et al. Bloodstream infections in critically ill patients with COVID-19. Eur J Clin Invest. 2020; 50(10): e13319. doi: 10.1111/eci.13319.
2. De Filippo O., D’Ascenzo F., Angelini F., et al. Reduced rate of hospital admissions for ACS during Covid-19 outbreak in Northern Italy. N Engl J Med. 2020; 383: 88-89. doi: 10.1056/ NEJMc2009166.
3. Clancy C.J., Nguyen M.H. COVID-19, superinfections and antimicrobial development: what can we expect? Clin Infect Dis. 2020; 71(10): 2736-2743. doi: 10.1093/cid/ciaa524.
4. Morrill H.J., Pogue J.M., Kaye K.S., LaPlante K.L. Treatment options for carbapenem-resistant Enterobacteriaceae infections. Open Forum Infect Dis. 2015; 2(2): ofv050. doi: 10.1093/ofid/ofv050.
5. Pitout J.D., Nordmann P., Poirel L. Carbapenemase-producing Klebsiella pneumoniae, a key pathogen set for global nosocomial dominance. Antimicrob Agents Chemother. 2015; 59(10): 5873-5884.
6. Munoz-Price L.S., Poirel L., Bonomo R.A,. et al. Clinical epidemiology of the global expansion of Klebsiella pneumoniae carbapenemases. Lancet Infect Dis. 2013; 13:785-796.
7. Canton R., Akova M., Carmeli Y., et al. Rapid evolution and spread of carbapenemases among Enterobacteriaceae in Europe. Clin Microbiol Infect. 2012; 18: 413-431.
8. Elbediwi M., Li Y., Paudyal N., et al. Global Burden of Colistin-Resistant Bacteria: Mobilized Colistin Resistance Genes Study (1980–2018). Microorganisms 2019. 7(10):461. doi: 10.3390/microorganisms7100461.
9. Giacobbe D.R., Del Bono V., Trecarichi E.M., et al. Risk factors for bloodstream infections due to colistin-resistant KPC-producing Klebsiella pneumoniae: results from a multicenter case–control–control study. Clin Microbiol Infect. 2015; 21(12): 1106-1108.
10. Srinivas P., Rivard K. Polymyxin resistance in gram-negative pathogens. Curr Infect Dis Rep. 2017;19(11):38. doi: 10.1007/s11908-017-0596-3.
11. Попов Д.А. Сравнительная характеристика современных методов определения продукции карбапенемаз. Клиническая микробиология и антимикробная химиотерапия. 2019; 21(2): 125-133.
12. Козлова Н.С., Баранцевич Н.Е., Баранцевич Е.П. Антибиотикорезистентность возбудителей гнойно-септических инфекций в многопрофильном стационаре. Проблемы медицинской микологии. 2018; 20(1): 40-48.
13. Эйдельштейн М.В., Журавлев В.С., Шек Е.А. Распространенность карбапенемаз среди нозокомиальных штаммов Еnterobacteriaceae в России. Изв. Сарат. ун-та. Нов. сер. Сер. Химия. Биология. Экология. 2017; 17(1): 36-41.
14. Kohler P.P., Volling C., Green K., et al. Carbapenem resistance, initial antibiotic therapy, and mortality in Klebsiella pneumoniae bacteremia: a systematic review and meta-analysis. Infect Control Hosp Epidemiol. 2017; 38(11): 1319-1328.
15. Falagas M.E., Tansarli G.S., Karageorgopoulos D.E., Vardakas K.Z. Deaths attributable to carbapenem-resistant enterobacteriaceae infections. Emerg Infect Dis 2014; 20 (7):1170-5.
16. Daikos G.L., Tsaousi S., Tzouvelekis L.S., et al. Carbapenemase-producing Klebsiella pneumoniae bloodstream infections: lowering mortality by antibiotic combination schemes and the role of carbapenems. Antimicrob Agents Chemother. 2014; 58(4): 2322-2328.
17. Papadimitriou-Olivgeris M, Fligou F, Bartzavali C et al. Carbapenemase-producing Klebsiella pneumoniae bloodstream infection in critically ill patients: risk factors and predictors of mortality. Eur J Clin Microbiol Infect Dis. 2017; 36(7):1125-1131.
18. Сухорукова М.В., Эйдельштейн М.В., Склеенова Е.Ю. и др. Антибиотикорезистентность нозокомиальных штаммов Enterobacteriaceae в стационарах России: результаты многоцентрового эпидемиологического исследования «МАРАФОН» в 2013–2014 гг. Клиническая микробиология и антимикробная химиотерапия 2017; 19(1): 49-56.
19. International standard ISO 20776-1. Clinical laboratory testing and in vitro diagnostic test systems – Susceptibility testing of infectious agents and evaluation of performance of antimicrobial susceptibility test devices – Part 1: Reference method for testing the in vitro activity of antimicrobial agents against rapidly growing aerobic bacteria involved in infectious diseases.
20. CLSI MEE. Performance Standards for Antimicrobial Susceptibility Testing: 29th Informational Supplement. Wayne, PA: Clinical and Laboratory Standards Institute; 2019.
21. EUCAST. Breakpoint Tables for Interpretation of MICs and Zone Diameters, Version 6.0. January 2016.: http://www.eucast. org/clinical_breakpoints/.
Antibiotic Resistance of Klebsiella Pneumoniae Strains Isolated from the Blood of Patients With COVID-19
Authors
Malygin A. S.
Сlinical Pharmacologist1
Andreev S. S.
Head, Department of Clinical Pharmacology, Clinical pharmacologist1
Tsarenko S. V.
Doctor of Medicine, Professor, Faculty of Fundamental Medicine2, Anesthesiologist-Resuscitator, Deputy Chief Physician for Anesthesiology and Resuscitation1
Petrushin M. A.
Anesthesiologist-resuscitator, Head of the Resuscitation Service3
1 - City Clinical Hospital №52, Moscow, Russia
2 - Moscow State University M.V. Lomonosov, Moscow, Russia
3 - Tver Regional Clinical Hospital, Tver, Russia
Corresponding author
Malygin A.S.; e-mail: dr.a.s.m@yandex.ru
Conflict of interests
None declared.
Funding
The study had no sponsorship.
Abstract
A retrospective analysis of case histories and the results of microbiological blood tests of patients with coronavirus infection COVID-19 who were treated in the infectious diseases hospital of the city clinical hospital №52 in Moscow in 2020 was carried out. The sensitivity to the main antibacterial agents was determined for each isolate of Klebsiella pneumoniae, the phenotype of each pathogen was characterized (MDR, XDR, PDR). The results of the study were statistically processed and presented in the form of a register of bacteremia cases. Most pathogens (79%) were isolated from the blood of patients who were treated in intensive care units. Klebsiella pneumoniae ranked first in the structure of bacteremias, the frequency of occurrence of the pathogen was 41,1% (282/686). Only 4% of Klebsiella pneumoniae isolates were sensitive to antibiotics; the phenotypes of antibiotic-resistant strains were MDR – 16%, XDR – 76%, PDR – 4%. Most of the isolated Klebsiella pneumoniae strains were carbapenem-resistant (85,4%), 11,1% were colistin-resistant, 10,6% of the isolates were extended spectrum β-lactamase producers.
Key words
bacteremia, antibiotic resistance, Klebsiella pneumoniae, COVID-19
DOI
References
1. Giacobbe D.R., Battaglini D., Ball L., et al. Bloodstream infections in critically ill patients with COVID-19. Eur J Clin Invest. 2020; 50(10): e13319. doi: 10.1111/eci.13319.
2. De Filippo O., D’Ascenzo F., Angelini F., et al. Reduced rate of hospital admissions for ACS during Covid-19 outbreak in Northern Italy. N Engl J Med. 2020; 383: 88-89. doi: 10.1056/ NEJMc2009166.
3. Clancy C.J., Nguyen M.H. COVID-19, superinfections and antimicrobial development: what can we expect? Clin Infect Dis. 2020; 71(10): 2736-2743. doi: 10.1093/cid/ciaa524.
4. Morrill H.J., Pogue J.M., Kaye K.S., LaPlante K.L. Treatment options for carbapenem-resistant Enterobacteriaceae infections. Open Forum Infect Dis. 2015; 2(2): ofv050. doi: 10.1093/ofid/ofv050.
5. Pitout J.D., Nordmann P., Poirel L. Carbapenemase-producing Klebsiella pneumoniae, a key pathogen set for global nosocomial dominance. Antimicrob Agents Chemother. 2015; 59(10): 5873-5884.
6. Munoz-Price L.S., Poirel L., Bonomo R.A,. et al. Clinical epidemiology of the global expansion of Klebsiella pneumoniae carbapenemases. Lancet Infect Dis. 2013; 13:785-796.
7. Canton R., Akova M., Carmeli Y., et al. Rapid evolution and spread of carbapenemases among Enterobacteriaceae in Europe. Clin Microbiol Infect. 2012; 18: 413-431.
8. Elbediwi M., Li Y., Paudyal N., et al. Global Burden of Colistin-Resistant Bacteria: Mobilized Colistin Resistance Genes Study (1980–2018). Microorganisms 2019. 7(10):461. doi: 10.3390/microorganisms7100461.
9. Giacobbe D.R., Del Bono V., Trecarichi E.M., et al. Risk factors for bloodstream infections due to colistin-resistant KPC-producing Klebsiella pneumoniae: results from a multicenter case–control–control study. Clin Microbiol Infect. 2015; 21(12): 1106-1108.
10. Srinivas P., Rivard K. Polymyxin resistance in gram-negative pathogens. Curr Infect Dis Rep. 2017;19(11):38. doi: 10.1007/s11908-017-0596-3.
11. Popov D.A. Sravnitel'naya harakteristika sovremennyh metodov opredeleniya produkcii karbapenemaz. [Comparative characteristics of modern methods for determining the production of carbapenemases.] Klinicheskaya mikrobiologiya i antimikrobnaya himioterapiya [Clinical microbiology and antimicrobial chemotherapy] 2019; 21(2): 125-133. (In Russ.)
12. Kozlova N.S., Barantsevich N.E., Barantsevich E.P. Antibiotikorezistentnost' vozbuditelej gnojno-septicheskih infekcij v mnogoprofil'nom stacionare. [Antibiotic resistance of causative agents of purulent-septic infections in a multidisciplinary hospital.] Problemy medicinskoj mikologii [Problems of medical mycology] 2018; 20(1): 40-48. (In Russ.)
13. Eidelstein M.V., Zhuravlev V.S., Shek E.A. Rasprostranennost' karbapenemaz sredi nozokomial'nyh shtammov Enterobacteriaceae v Rossii. [Prevalence of carbapenemases among nosocomial strains of Enterobacteriaceae in Russia,] Izv. Sarat. un-ta. Nov. ser. Ser. Himiya. Biologiya. Ekologiya [Bulletin of Saratov University. New series. Chemistry. Biology. Ecology] 2017; 17(1): 36-41. (In Russ.)
14. Kohler P.P., Volling C., Green K., et al. Carbapenem resistance, initial antibiotic therapy, and mortality in Klebsiella pneumoniae bacteremia: a systematic review and meta-analysis. Infect Control Hosp Epidemiol. 2017; 38(11): 1319-1328.
15. Falagas M.E., Tansarli G.S., Karageorgopoulos D.E., Vardakas K.Z. Deaths attributable to carbapenem-resistant enterobacteriaceae infections. Emerg Infect Dis 2014; 20 (7):1170-5.
16. Daikos G.L., Tsaousi S., Tzouvelekis L.S., et al. Carbapenemase-producing Klebsiella pneumoniae bloodstream infections: lowering mortality by antibiotic combination schemes and the role of carbapenems. Antimicrob Agents Chemother. 2014; 58(4): 2322-2328.
17. Papadimitriou-Olivgeris M, Fligou F, Bartzavali C et al. Carbapenemase-producing Klebsiella pneumoniae bloodstream infection in critically ill patients: risk factors and predictors of mortality. Eur J Clin Microbiol Infect Dis. 2017; 36(7):1125-1131.
18. Sukhorukova M.V., Eidelstein M.V., Skleenova E.Yu. et al. Antibiotikorezistentnost' nozokomial'nyh shtammov Enterobacteriaceae v stacionarah Rossii: rezul'taty mnogocentrovogo epidemiologicheskogo issledovaniya «MARAFON» v 2013–2014 gg. [Antibiotic resistance of nosocomial strains of Enterobacteriaceae in hospitals in Russia: results of a multicenter epidemiological study «MARATHON» in 2013–2014] Klinicheskaya mikrobiologiya i antimikrobnaya himioterapiya [Clinical Microbiology and Antimicrobial Chemotherapy] 2017; 19(1): 49-56. (In Russ.)
19. International standard ISO 20776-1. Clinical laboratory testing and in vitro diagnostic test systems – Susceptibility testing of infectious agents and evaluation of performance of antimicrobial susceptibility test devices – Part 1: Reference method for testing the in vitro activity of antimicrobial agents against rapidly growing aerobic bacteria involved in infectious diseases.
20. CLSI MEE. Performance Standards for Antimicrobial Susceptibility Testing: 29th Informational Supplement. Wayne, PA: Clinical and Laboratory Standards Institute; 2019.
21. EUCAST. Breakpoint Tables for Interpretation of MICs and Zone Diameters, Version 6.0. January 2016.: http://www.eucast. org/clinical_breakpoints/.