Авторы
Мухаметзянов А. М.
д.м.н., главный врач1; доцент, заведующий кафедрой эпидемиологии2
ORCID 0000-0002-0448-1273
Кайданек Т. В.
к.м.н., доцент, кафедра эпидемиологии 2
ORCID 0000-0002-7754-3551
Латыпов А. А.
клинический ординатор, кафедра эпидемиологии2
ORCID 0009-0006-1119-8309
Валеева Д. С.
заместитель главного врача по медицинской части3
ORCID 0000-0002-4421-0005
Пономарева Д. Н.
врач эпидемиолог3
ORCID 0009-0004-8795-7776
Ермоленко И. А.
врач пульмонолог3
ORCID 0009-0007-5537-3858
Газизова А. Г.
врач бактериолог3
ORCID 0009-0004-6287-2020
1ГБУЗ «Республиканская клиническая инфекционная больница», г. Уфа, Российская Федерация
2ФГБОУ ВО «Башкирский государственный медицинский университет» Минздрава России, г. Уфа, Российская Федерация
3ГБУЗ «Республиканская детская клиническая больница», г. Уфа, Российская Федерация
Автор для корреспонденции
Латыпов Алмаз Айратович; e-mail: almaz.latup@mail.ru
Финансирование
Исследование не имело спонсорской поддержки.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Аннотация
В статье представлены результаты микробиологического мониторинга микроорганизмов респираторного тракта пациентов с муковисцидозом (МВ), изменения спектра, палитры, и антибактериальной устойчивости при неоднократных госпитализациях в специализированный стационар. Цель исследования. Проанализировать результаты микробиологического исследования биоматериала респираторного тракта детей с МВ, госпитализированных в многопрофильный детский стационар, для оптимизации эпидемиологического надзора на локальном уровне. Материалы и методы. Материалом для изучения послужили результаты микробиологического исследования мазков из зева, носа или индуцированная мокрота пациентов с муковисцидозом, наблюдающихся в детском Центре муковисцидоза (МВ). Идентификацию выделенных культур проводили классическими бактериологическими методами. В последующем выделенные микроорганизмы были систематизированы до вида. Анализ проведен за 2019-2023 гг. Определение чувствительности к антибактериальным препаратам проводилось диско-диффузионным методом. Рассчитаны показатели частоты (%) выделения различных микроорганизмов, частоты (%) резистентных микроорганизмов к применяемым антимикробным препаратам в медицинской организации (МО). Проведено сравнение показателей частоты (%) и спектра выделенных культур при первичной и последующих госпитализациях в Детский центр муковисцидоза. Для относительных величин рассчитывались доверительные интервалы (ДИ (95%)). Расчеты проведены с использованием эпидемиологического калькулятора Confidence Interval Calculator. Результаты. В структуре выделенных культур из биоматериала респираторного тракта детей с муковисцидозом 45,4% составили грамотрицательные микроорганизмы. При первичной и последующих госпитализациях наиболее часто выделялись Pseudomonas aeruginosa, Klebsiella pneumoniae, Stenotrophomonas maltophilia. Грамположительные микроорганизмы в спектре выделенных культур составили 37,9%. Большая часть среди выделенных грамположительных микроорганизмов представлена Staphylococcus aureus (75,7%). При повторных госпитализациях в детский Центр МВ по результатам мониторинга определены изменения спектра, частоты выделения и спектра устойчивости к антимикробным препаратам. Определено увеличение частоты (р<0,05) выделения Pseudomonas aeruginosa, Staphylococcus aureus. При повторных госпитализациях увеличилась частота выделения ассоциаций микроорганизмов от 50,5% (ДИ [45,3; 55,7]) до 81,4% (ДИ [79,0; 83,8]) (р<0,05). Определено увеличение частоты (р<0,05) выделения резистентных штаммов Pseudomonas aeruginosa к антибактериальным препаратам резерва в 3,2 раза при последующих госпитализациях. Заключение. Выявленные изменения спектра, частоты, палитры и антибиотикорезистентности микроорганизмов респираторного тракта больных МВ на локальном уровне эпидемиологического надзора указывают на необходимость разработки алгоритмов действий в условиях амбулаторного и стационарного ведения пациентов с МВ для обеспечения эпидемиологической безопасности медицинской деятельности и повышения качества оказания медицинской помощи.
Ключевые слова
муковисцидоз, микробиологический мониторинг, хроническая инфекция легких, антибиотикорезистеность, эпидемиологический риск, эпидемиологический надзор
Для цитирования
Мухаметзянов А. М., Кайданек Т. В., Латыпов А. А., Валеева Д. С., Пономарева Д. Н., Ермоленко И. А., Газизова А. Г. Микробный пейзаж респираторного тракта детей с муковисцидозом: результаты мониторинга. Медицина 2024; 12(4): 43-59
DOI
Введение
Муковисцидоз (МВ) (кистозный фиброз, cystic fibrosis, CF) является одним из наиболее распространенных аутосомно-рецессивных заболеваний, которое характеризуется поражением экзокринных желез организма [3]. Частота заболевания МВ в Европе составляет 4 случай на 10 000 новорожденных, а в РФ – 1 на 10 000 новорожденных [3,11]. Причина заболевания – мутация гена СFTR (трансмембранного регулятора МВ), расположенного на длинном плече 7-й хромосомы [5], отвечающего за секреторные процессы [1,4,5]. Мутация этого гена приводит к задержке ионов натрия и воды, сгущению секрета экзокринных желез с поражением различных органов и систем – в первую очередь легких и пищеварительной системы [3,5].
Рецидивирующие и хронические инфекции респираторного тракта у больных с МВ поддерживаются накоплением в дыхательных путях густого и вязкого секрета, который служит идеальной питательной средой для роста и размножения различных микроорганизмов [8,9]. В связи с особенностями течения заболевания, пациенты с МВ нуждаются в регулярном лечении в условиях стационара, а также госпитализируются в экстренном порядке. Хронические инфекции легких у таких больных в 60% случаев вызываются ассоциацией микроорганизмов, как госпитального, так и внегоспитального происхождения [9,10]. Основными возбудителями хронической инфекции легких являются Staphylococcus aureus, Pseudomonas aeruginosa, бактерии комплекса Burkholderia cepacia и бактерии рода Achromobacter [10], которые могут представлять эпидемиологическую опасность в условиях оказания медицинской помощи.
Под действием различного рода факторов у пациентов с МВ спектр микроорганизмов респираторного тракта и их ассоциации может изменяться [8,9,17], что важно изучать для персонализации лечебной тактики, в том числе назначения антибактериальной терапии [3] и оптимизации эпидемиологического надзора на локальном уровне для обеспечения эпидемиологической безопасности при оказании специализированной медицинской помощи. Наполнение информационной подсистемы и результаты диагностической подсистемы системы эпидемиологического надзора за МВ в условиях цифровой трансформации здравоохранения являются необходимыми для оптимизации и контроля исполнения алгоритмов оказания медицинской помощи, в том числе в разрезе обеспечения эпидемиологической безопасности, синергии действий специалистов для повышения качества и снижения социальной значимости патологии.
Цель исследования
Цель настоящего исследования – проанализировать результаты микробиологических исследований биоматериала респираторного тракта детей с МВ, госпитализированных в многопрофильный детский стационар, для оптимизации эпидемиологического надзора на локальном уровне.
Материалы и методы исследования
Исследование было проведено на базе детской клинической больницы на 618 коек, на базе которой создан Детский центр муковисцидоза (пульмонологическое отделение). Микробиологический мониторинг микрофлоры проводился на основании требований: МУ 4.2.2039-05 «Техника сбора и транспортирования биоматериалов в микробиологические лаборатории», Клинических рекомендаций «Кистозный фиброз (муковисцидоз)» 2021 г., утвержденных Минздравом РФ.
Результаты микробиологических исследований микрофлоры дыхательного тракта пациентов с диагнозом муковисцидоз изучены за 2019-2023 гг. В целом, на конец 2023 г. в Детском центре муковисцидоза на диспансерном учете состояло 65 детей. Все дети – жители Республики Башкортостан (РБ), среди которых 80,4% госпитализировались повторно за исследуемый период. Проанализированы 233 медицинских карт (учетная форма №003/у) пациентов, получивших медицинскую помощь в стационарных условиях с диагнозом МВ за указанный период.
Пациентам при каждой госпитализации проводилось микробиологическое исследование микрофлоры верхних и нижних дыхательных путей. Для анализа микробной флоры у пациентов брали глубокий мазок из зева и носа или индуцированную мокроту. Мазок из зева (глотки) осуществлялся натощак или через 3-4 ч. после приема пищи согласно МУ 4.2.2039-051. Индуцированную мокроту собирали в стерильный одноразовый контейнер. Выделение культур проводилось с использованием соответствующих питательных сред [12]. Морфологические свойства выделенных бактерий изучали путём микроскопии мазков, окрашенных по Граму [12]. Выделенные микроорганизмы были систематизированы до вида. Определение чувствительности к антибактериальным препаратам проводилось диско-диффузионным методом на агаре Мюллера–Хинтона и с использованием тест-системы ATB pse 5 (Biomerieux, Франция). Система мониторинга за антимикробной резистентностью проводилась с помощью использования программы WHONET [15].
Результаты микробиологических исследований микрофлоры дыхательного тракта пациентов с МВ проанализированы путем расчета показателей частоты (%) выделения различных микроорганизмов, частоты (%) резистентных микроорганизмов к применяемым антимикробным препаратам. Проведено сравнение показателей частоты (%) и спектра выделенных культур при первичной госпитализации в Детский центр муковисцидоза и последующих госпитализаций. Для относительных величин рассчитывались доверительные интервалы [ДИ]. (95%). Расчеты проведены с использованием эпидемиологического калькулятора Confidence Interval Calculator.
Результаты исследования
За анализируемый период (2019-2023гг.) взят 351 образец биологического материала для микробиологического исследования микрофлоры респираторного тракта больных с МВ. Выделено 478 культур микроорганизмов. Частота выделения в среднем за анализируемый период составила 136,2 (ДИ [132,4; 140,0]) на 100 исследований (табл. 1), не были выделены культуры в 12,5% (ДИ [10,7; 14,3]) образцов. Последнее требует поиска решений по оптимизации преаналитического и аналитического этапа микробиологического исследования.
Ведущее место в структуре выделенных культур за анализируемый период занимали грамотрицательные микроорганизмы, доля которых составила 45,4%. Частота выделения 61,8 (ДИ [59,2; 64,4]) на 100 исследований (табл. 1). Доля культур грамположительных микроорганизмов 37,9%, частота выделения была близкой с грамотрицательным микроорганизмам – 51,6 (ДИ [48,9; 54,3] (р<0,05)). Доля грибов рода Candida в изучаемых образцах составила 16,7%, частота выделения 22,8% (ДИ [20,6; 25,0]), отличалась (р<0,05) от таковой по микроорганизмам.
Таблица 1. Частота и структура микрофлоры респираторного тракта больных с МВ в 2019-2023 гг. (%)
| № | Микроорганизм | Структура по группам % | Частота выделения микроорганизмов на 100 исследований ±ДИ (95%) | |
|---|---|---|---|---|
| Кол-во (абс.) | % | |||
| 1 | Грамотрицательные бактерии | 217 | 45,4 | 61,8 [59,2; 64,4] |
| 2 | Грамположительные бактерии | 181 | 37,9 | 51,6 [48,9; 54,3] |
| 3 | Грибы | 80 | 16,7 | 22,8 [20,6; 25,0] |
| Всего | 478 | 100 | 136,2 [132,4; 140,0;] | |
Определена зависимость частоты выделения некоторых микроорганизмов от количества госпитализаций пациентов с МВ. Среди грамотрицательных микроорганизмов при первичной и последующих госпитализациях наиболее часто выделялись Pseudomonas aeruginosa, Klebsiella pneumoniae, Stenotrophomonas maltophilia (рис.1).
Рис 1. Частота выделения грамотрицательных микроорганизмов от пациентов больных с МВ при первичной и последующих госпитализациях (на 100 анализов (%).

Частота выделения Pseudomonas aeruginosa, по сравнению с первичной, в последующих госпитализациях статистически достоверно (р<0,05) увеличивалась в 1,5 раза, от 21,5 (ДИ [17,2; 25,8]) до 31,8 (ДИ [28,9; 34,7]) на 100 исследований, что можно рассматривать как нежелательное событие [19], которое при определенных обстоятельствах, как показывают исследования [8,16,17,18], может увеличить эпидемиологический риск. Частота выделения Klebsiella pneumoniae, по сравнению с первичной, в последующих госпитализациях сохранялась на одном уровне – 7,5 (ДИ [4,8; 10,2]), 6,6 (ДИ [5,1; 8,1]) на 100 исследований соответственно. Частота выделения Stenotrophomonas maltophilia оказалась одинаковой (5,4 (ДИ [3,0; 7,8]) на 100 исследований) при первичной и в последующих госпитализациях (рис 1.). Среди грамотрицательных микроорганизмов близкими по частоте выделения были Echerichia coli 6,6 (ДИ [5,1; 8,1]), Enterobacter cloacae 4,3 (ДИ [2,2; 6,4]) и Burkholderia cepacia 1,6 (ДИ [0,8; 2,4]) на 100 исследований. Единичные высевы были: Pantoae asslomerens 0,4 (ДИ [0,0; 0,8]), Acinetobacter baumanii 0,4 (ДИ [0,0; 0,8]), Haemophilus influenzae 0,4 (ДИ [0,0; 0,8]), Sphingomonas paucimobilis 0,4 (ДИ [0,0; 0,8]), Kluyvera cryocrescens 0,4 (ДИ [0,0; 0,8]), Pseudomonas putida 0,4 (ДИ [0,0; 0,8]), Acinetobacter haemolyticus 0,4 (ДИ [0,0; 0,8]), Pseudomonas mendocina 0,4 (ДИ [0,0; 0,8]), Acinetobacter indologenes 0,4 (ДИ [0,0; 0,8]) на 100 исследований. Выделенный спектр микроорганизмов близок, как и в других исследованиях [2,5,6,8].
Большая часть среди выделенных грамположительных микроорганизмов представлена Staphylococcus aureus (75,7%). По результатам микробиологических исследований, частота выделения Staphylococcus aureus в последующих госпитализациях статистически достоверно (р<0,05) увеличивалась в 1,6 раза на 100 исследований, от 26,88 (ДИ [22,28; 31,48]) до 43,40 (ДИ [40,3; 46,5]) по сравнению с первичной (рис. 2), что подтверждает значение Staphylococcus aureus в хроническом воспалении респираторного тракта. Среди грамположительных микроорганизмов близкими по частоте выделения были Streptococcus oralis 5,4% (ДИ [4,0; 6,8]), Staphylococcus epidermidis 4,3% (ДИ [2,2; 6,4]) и Enterococcus faecalis 2,2% (ДИ [0,7; 3,7]). Среди единичных высевов: Streptococcus agalactiae 1,1% (ДИ [0,1; 2,1]), Staphylococcus haemolyticus 1,1% (ДИ [0,1; 2,1]), Streptococcus pneumonia 1,1% (ДИ [0,1; 2,1]) и Streptococcus pyogenes 1,1% (ДИ [0,1; 2,1]). При первой госпитализации в центр МВ MRSA тест был отрицательным во всех исследованиях. При повторных госпитализациях в биоматериале были получены единичные положительные результаты на MRSA тест, что указывает на нарастание эпидемиологического риска, связанного с формированием устойчивости к антибактериальным препаратам, с увеличением количества госпитализаций.
Рис 2. Частота выделения грамположительных микроорганизмов от пациентов больных с МВ при первичной и последующих госпитализациях (на 100 анализов (%).

Частота выделения Candida albicans, как при первой, так и в последующих госпитализациях была близкой – 20,4 (ДИ [16,2; 24,6]) и 19,0 (ДИ [16,6; 21,4]) на 100 исследований соответственно. Частота выделения других видов грибов была редкой и не менялась при последующих госпитализациях.
Особое эпидемиологическое и клиническое значение имеет определение частоты встречаемости и спектр микроорганизмов в ассоциациях.
В нашем исследовании частота выделения ассоциации составила 73,2% (ДИ [70,8; 75,6]), в среднем определено от 2 до 5 различных сочетаний микроорганизмов, что согласуется с исследованиями [4,5] указывающими, что с первых месяцев жизни у больных с МВ происходит колонизация респираторного тракта различной микрофлорой, в основном ассоциациями различных условно–патогенных микроорганизмов. Определен состав ассоциаций микроорганизмов, которые наиболее часто встречались в исследуемых образцах и частота которых увеличивалась с последующими госпитализациями: при первичной госпитализации Pseudomonas aeruginosa+Staphylococcus aureus 4,3% (ДИ [2,2; 6,4]), Pseudomonas aeruginosa+Candida albicans+Staphylococcus aureus 1,1% (ДИ [0,0; 2,2]), в последующих госпитализациях Pseudomonas aeruginosa+Staphylococcus aureus 9,7% (ДИ [7,9; 11,5]), Pseudomonas aeruginosa+Candida albicans+Staphylococcus aureus 3,1% (ДИ [2,1; 4,1]). Частота выделения ассоциаций микроорганизмов увеличивалась в последующих госпитализациях. При первичной госпитализации в 50,5% (ДИ [45,3; 55,7]) образцов, при последующих госпитализациях в 81,4% (ДИ [79,0; 83,8]) (р<0,05) определялись ассоциации микроорганизмов (рис. 3).
Рис. 3. Частота выделения ассоциаций микроорганизмов у больных с МВ при первичной госпитализации и последующих госпитализациях (%).

При первичной госпитализации у 23 пациентов были выделены 16 видов ассоциаций, из которых 4 встречались неоднократно. При последующей госпитализации в 91 образце биоматериала были выделены 43 вида ассоциаций, из которых 13 встречались неоднократно. Указанное необходимо учитывать при персонализированной тактике лечения и синергии действии специалистов для обеспечения качества оказания медицинской помощи.
С увеличением количества госпитализаций пациентов с МВ нарастает частота выделения ассоциаций и меняется палитра сочетаний, что, безусловно, увеличивает риск заноса и распространения микроорганизмов в госпитальной среде при несоблюдении алгоритмов действий по обеспечению эпидемиологической безопасности в условиях оказания медицинской помощи III уровня, несмотря на условия нахождения пациентов в боксированных палатах. Указанный риск имеет определенную степень вероятности в связи с необходимостью перемещения пациентов по медицинской организации для лечебно-диагностических действий.
При выборе тактики лечения пациентов с МВ для эффективности имеет важное значение определение чувствительности выделенных микроорганизмов к антимикробным препаратам [3,6]. Из всего многообразия выделенных культур по данным некоторых исследований [6] чаще других проявляются свойства резистентности к антибиотикам у Burkholderia cepacia и Pseudomonas aeruginosa, так как они обладают природной антибиотикорезистентью, что затрудняет эрадикацию этих микроорганизмов в процессе лечения и значительно утяжеляет течение заболевания [6]. В нашем исследовании выделение Burkholderia cepacia было большой редкостью среди пациентов, находящихся на учете в Детском центре муковисцидоза. В исследованиях [13,14], данный микроорганизм представляет собой высокий эпидемиологический риск распространения в условиях госпитальной среды при нарушении противоэпидемического режима.
При оценке резистентности выделенных штаммов Pseudomonas aeruginosa к антибиотикам частота выделения резистентных штаммов, по сравнению с первичной и последующими госпитализациями, была сохранена: 55,0% (ДИ [43,6; 66,4]), 59,8% (ДИ [54,4; 65,2]) соответственно (рис. 4.).
Рис. 4. Резистентность к антибактериальным препаратам Pseudomonas aeruginosa, выделенного от больных с МВ при первичной и последующих госпитализациях (на 100 культур (%)).

Частота выделения резистентных штаммов Pseudomonas aeruginosa к цефтазидиму в последующих госпитализациях, по сравнению с первичной, была сохранена (р>0,05) от 15,0% (ДИ [6,8; 23,2]), до 18,3% (ДИ [14,0; 22,6]) соответственно (табл. 2).
Таблица 2. Резистентность к антибактериальным препаратам Pseudomonas aeruginosa, выделенного от больных с МВ при первичной и последующих госпитализациях (на 100 культур (%)).
| № | Препарат | первичная госпитализация (n=20) | последующие госпитализации (n=82) | ||
|---|---|---|---|---|---|
| Кол-во | Частота выделения резистентных штаммов на 100 культур ±ДИ (95%) | Кол-во | Частота выделения резистентных штаммов на 100 культур ±ДИ (95%) | ||
| 1 | Цефтазидим | 3 | 15,0 [6,8; 23,2] | 15 | 18,3 [14,0; 22,6] |
| 2 | Ко-тримоксазол | 3 | 15,0 [6,8; 23,2] | 1 | 1,2* [0,0; 2,4] |
| 3 | Ампициллин | 3 | 15,0 [6,8; 23,2] | 0 | 0,0 |
| 4 | Амп/сульбактам | 2 | 10,0 [3,1; 16,9] | 5 | 6,1 [3,4; 8,8] |
| 6 | Цефотаксим | 2 | 10,0 [3,1; 16,9] | 4 | 4,9 [2,5; 7,3] |
| 7 | Цефепим | 1 | 5,0±5,0 [0,0; 10,0] | 12 | 14,6 [10,6; 18,6] |
| 8 | Цефтриаксон | 1 | 5,0±5,0 [0,0; 10,0] | 11 | 13,4 [9,6; 17,2] |
| 9 | Амикацин | 0 | 0,0 | 8 | 9,8 [6,5 ; 13,1] |
| 10 | Ципрофлоксацин | 0 | 0,0 | 5 | 6,1 [3,4 ; 8,8] |
| 11 | Левофлоксацин | 0 | 0,0 | 3 | 3,7* [1,6 ; 5,8] |
| 12 | Имипенем | 0 | 0,0 | 3 | 3,7* [1,6 ; 5,8] |
| 13 | Меропенем | 0 | 0,0 | 2 | 2,4* [0,7; 4,1] |
| 14 | Азлоциллин | 0 | 0,0 | 2 | 2,4* [0,7; 4,1] |
| 15 | Азтреонам | 0 | 0,0 | 1 | 1,2* [0,0; 2,4] |
| 16 | Эритромицин | 0 | 0,0 | 1 | 1,2* [0,0; 2,4] |
| 17 | Оксациллин | 0 | 0,0 | 1 | 1,2* [0,0; 2,4] |
| 18 | Гентамицин | 0 | 0,0 | 1 | 1,2* [0,0; 2,4] |
| 19 | Тобрамицин | 0 | 0,0 | 1 | 1,2* [0,0; 2,4] |
| Всего резистентных | 11 | 55,0 [43,6; 66,4] | 49 | 59,8 [54,4; 65,2;] | |
| Отсутствие резистентности | 9 | 45,0 [33,6; 56,4] | 33 | 40,2 [34,8; 45,6] | |
* показатель статистически не значим.
При последующих госпитализациях наблюдалось увеличение частоты (р<0,05) выделения резистентных штаммов Pseudomonas aeruginosa к антибиотикам – цефепиму, цефтриаксону, амикацину и ципрофлоксацину от 6,1% (ДИ [3,4; 8,8]) до 14,6% (ДИ [10,6; 18,6]) на 100 выделенных культур. Резистентность Pseudomonas aeruginosa к другим антибиотикам была близкой по частоте (табл. 2). Выявлено увеличение частоты (р<0,05) выделения резистентных штаммов Pseudomonas aeruginosa при последующих госпитализациях к антибиотикам групп резерва в 3,2 раза, от единичных находок до 15,9% (ДИ [11,8; 20,0]) на 100 выделенных культур. При повторных госпитализациях у пациентов спектр антибиотиков, к которым формируется устойчивость, стал шире. Такие изменения требуют поиска решений по определению тактики ведения пациентов разработки или оптимизации алгоритмов на основе синергии действии специалистов (клинический фармаколог, врач пульмонолог, врач бактериолог, врач эпидемиолог).
Частота выделения резистентных к антибиотикам штаммов Staphylococcus aureus по сравнению с первичной в последующих госпитализациях значимо (р>0,05) не изменилась 36,0% (ДИ [26,2; 45,8]) и 43,0% (ДИ [38,3; 47,7]) соответственно (рис. 5).
Рис. 5. Резистентность к антибактериальным препаратам Staphylococcus aureus, выделенного от больных с МВ при первичной и последующих госпитализациях (на 100 культур (%)).
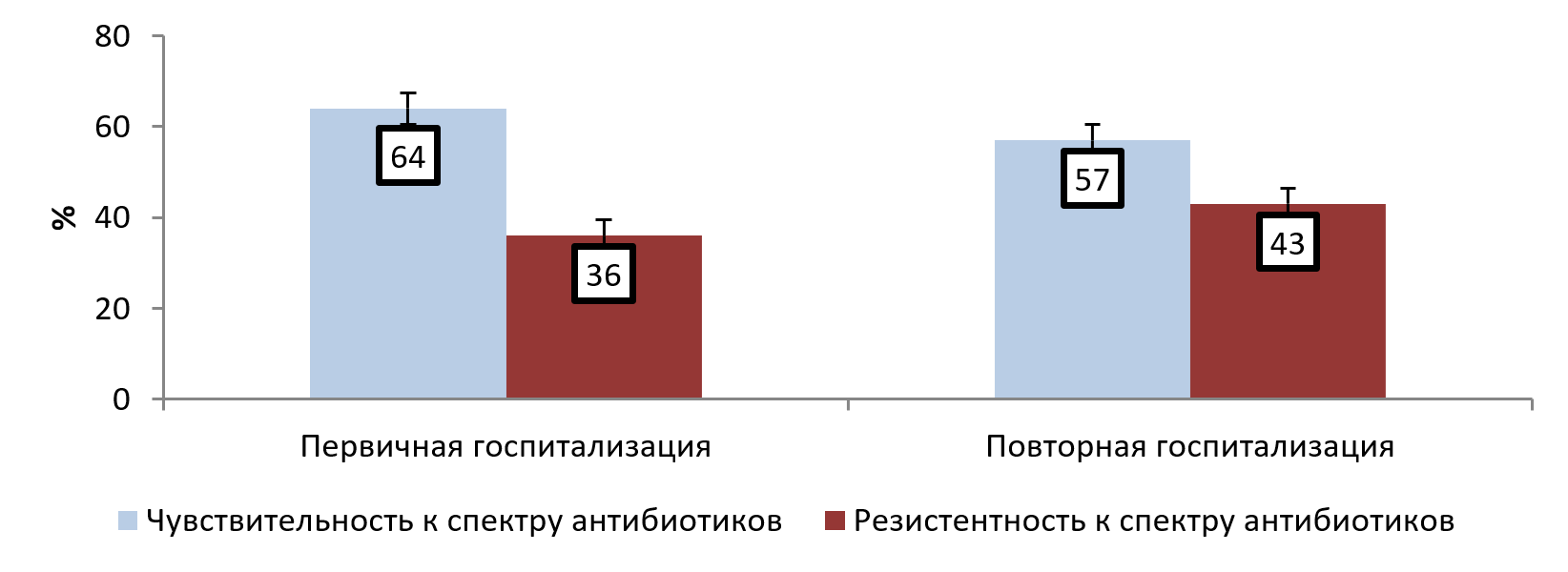
Частота выделения резистентных штаммов Staphylococcus aureus к кларитромицину, эритромицину, клиндамицину, по сравнению с первичной и в последующих госпитализациях, также не изменилась (табл. 3). При последующих госпитализациях наблюдалось увеличение частоты (р<0,05) выделения резистентных штаммов Staphylococcus aureus к следующим антибиотикам: амоксициллин/клавулановой кислоте, гентамицину, азитромицину, оксациллину, амикацину, ципрофлоксацину и норфлоксацину от 4,5 (ДИ [2,7; 6,3]) до 13,4 (ДИ [10,2; 16,6]) на 100 выделенных культур (табл. 3). Резистентность Staphylococcus aureus к другим антибиотикам была близкой по частоте (табл. 3). Выявлено увеличение частоты (р<0,05) выделения резистентных штаммов Staphylococcus aureus при последующих госпитализациях к антибиотикам стартовой терапии (I-линия) и основной группы (II-линия) в 4,8 и 2,4 раза соответственно, от единичных находок до 38,4 (ДИ [33,8; 43,0]) на 100 выделенных культур и от 28,0 (ДИ [18,8; 37,2]) до 66,9 (ДИ [62,4; 71,4]) на 100 выделенных культур. Рациональное использование антимикробных препаратов с учетом спектра их активности и профиля антибиотикорезистентности микроорганизмов у пациентов с МВ является основой снижения социальных, эпидемиологических и экономических рисков, как в условиях специализированного стационара, так и в амбулаторном ведении.
Таблица 3. Резистентность к антибактериальным препаратам Staphylococcus aureus, выделенного от больных с МВ при первичной и последующих госпитализациях (на 100 культур (%)).
| № | Препарат | первичная госпитализация (n=25) | последующие госпитализации (n=112) | ||
|---|---|---|---|---|---|
| Кол-во | Частота выделения резистентных штаммов на 100 культур ±ДИ (95%) | Кол-во | Частота выделения резистентных штаммов на 100 культур ±ДИ (95%) | ||
| 1 | Кларитромицин | 4 | 16,0 [8,6; 23,4] | 24 | 21,4 [17,6; 25,2] |
| 2 | Эритромицин | 2 | 8,0 [2,5; 13,5] | 8 | 7,1 [4,7; 9,5] |
| 3 | Клиндамицин | 2 | 8,0 [2,5; 13,5] | 7 | 6,3 [4,0; 8,6] |
| 4 | Азитромицин | 1 | 4,0 [0,0; 8,0] | 15 | 13,4 [10,2; 16,6] |
| 5 | Гентамицин | 0 | 0,0 | 9 | 8,0 [5,4;10,6] |
| 6 | Амоксициллин/ клавулановая кислота | 0 | 0,0 | 10 | 8,9 [6,2;11,6] |
| 7 | Оксациллин | 0 | 0,0 | 6 | 5,4 [3,3;7,5] |
| 8 | Амикацин | 0 | 0,0 | 5 | 4,5 [2,7; 6,3] |
| 9 | Ципрофлоксацин | 0 | 0,0 | 5 | 4,5 [2,7; 6,3] |
| 10 | Норфлоксацин | 0 | 0,0 | 5 | 4,5 [2,7; 6,3] |
| 11 | Офлоксацин | 0 | 0,0 | 4 | 3,6 [1,8; 5,4] |
| 12 | Ванкомицин | 0 | 0,0 | 3 | 2,7* [1,2; 4,2] |
| 13 | Цефокситин | 0 | 0,0 | 3 | 2,7* [1,2; 4,2] |
| 14 | Рифампицин | 0 | 0,0 | 2 | 1,8* [0,5; 3,1] |
| 15 | Ко-тримоксазол | 0 | 0,0 | 3 | 2,7* [1,2; 4,2] |
| 16 | Доксициклин | 0 | 0,0 | 2 | 1,8* [0,5; 3,1] |
| 17 | Хлорамфеникол | 0 | 0,0 | 2 | 1,8* [0,5; 3,1] |
| 18 | Цефтазидим | 0 | 0,0 | 1 | 0,9* [0,0; 1,8] |
| 19 | Цефазолин | 0 | 0,0 | 1 | 0,9* [0,0; 1,8] |
| 20 | Линезолид | 0 | 0,0 | 1 | 0,9* [0,0; 1,8] |
| 21 | Цефоперазон | 0 | 0,0 | 1 | 0,9* [0,0; 1,8] |
| 22 | Бензилпенициллин | 0 | 0,0 | 1 | 0,9* [0,0; 1,8] |
| 23 | Линкомицин | 0 | 0,0 | 1 | 0,9* [0,0; 1,8] |
| Всего резистентных | 9 | 36,0 [26,2; 45,8] | 48 | 42,9 [38,2; 47,6] | |
| Отсутствие резистентности | 16 | 64,0 [54,2; 73,8;] | 64 | 57,1 [52,4; 61,8] | |
* показатель статистически не значим.
Частота выявления резистентных штаммов Candida albicans к противогрибковым препаратам в последующих госпитализациях, увеличивалась в 1,6 раза от 26,0% (ДИ [15,9; 36,7]) до 43% (ДИ [35,8; 50,0]) (р<0,05) (рис 6.).
Рис. 6. Резистентность к противогрибковым препаратам Candida albicans, выделенного от больных с МВ при первичной и последующих госпитализациях (на 100 культур (%).

При оценке резистентности Candida albicans к противогрибковым препаратам при последующих госпитализациях по сравнению с первичной, определено увеличение частоты устойчивости к флуконазолу в 1,6 раза, от 26,3 % (ДИ [15,9; 36,7]) до 42,9% (ДИ [35,8; 50,0]), вориконазолу в 1,6 раза от 21,1% (ДИ [11,5; 30,7]) до 34,7% (ДИ [27,8; 41,6]) (табл. 4). Указанное предполагает поиск решений по эффективному применению препаратов с учетом персонализированного результата исследования.
Таблица 4. Резистентность к противогрибковым препаратам Candida albicans, выделенного от больных с МВ при первичной и последующих госпитализациях (на 100 культур (%).
| № | Препарат | первичная госпитализация (n=19) | последующие госпитализации (n=49) | ||
|---|---|---|---|---|---|
| Кол-во | Частота выделения резистентных на 100 культур ±ДИ (95%) | Кол-во | Частота выделения резистентных на 100 культур ±ДИ (95%) | ||
| 1 | Флуконазол | 5 | 26,3 [15,9; 36,7] | 21 | 42,9 [35,8; 50,0] |
| 2 | Вориконазол | 4 | 21,1 [11,5; 30,7] | 17 | 34,7 [27,8; 41,6] |
| 3 | Кетоконазол | 2 | 10,5 [3,3; 17,7] | 2 | 4,1 [1,2; 7,0] |
| 4 | Амфотерицин В | 0 | 0,0 | 1 | 2,0 [0,0; 4,0] |
| 5 | Клотримазол | 2 | 10,5 [3,3; 17,7] | 0 | 0,0 |
| 6 | Итраконазол | 1 | 5,3±5,3 [0,0; 10,6] | 0 | 0,0 |
| Всего резистентных | 5 | 26,3 [15,9; 36,7] | 21 | 42,9 [35,8; 50,0] | |
| Отсутствие резистентности | 14 | 73,7±10,4 [0,0; 8,0] | 28 | 57,1±7,1 [0,0; 8,0] | |
Заключение
По результатам мониторинга микроорганизмов респираторного тракта при повторных госпитализациях в детский Центр МВ определены изменения спектра выделяемых микроорганизмов, частоты и устойчивости к антимикробным препаратам. Определено увеличение частоты (р<0,05) выделения Pseudomonas aeruginosa, Staphylococcus aureus. Регистрация случаев положительного MRSA теста при повторных госпитализациях указывает на увеличение эпидемиологического риска. При повторных госпитализациях увеличивается частота выделения ассоциаций микроорганизмов от 50,5% (ДИ [45,3; 55,7]) до 81,4% (ДИ [79,0; 83,8] (р<0,05)). Спектр микроорганизмов включал в себя 16 и 43 вида ассоциаций соответственно, и изменялся при повторных госпитализациях по палитре сочетаний. Определены значимые (р<0,05) изменения частоты выделения микроорганизмов критически высокого уровня резистентности (Pseudomonas aeruginosa) и высокого уровня приоритетности (Staphylococcus aureus) по антимикробной резистентности. Определено увеличение частоты (р<0,05) выделения резистентных штаммов Pseudomonas aeruginosa к антибактериальным препаратам резерва в 3,2 раза при последующих госпитализациях.
Выявленные закономерности на локальном уровне эпидемиологического надзора изменений спектра, частоты, палитры и антибиотикорезистентности микроорганизмов респираторного тракта больных МВ указывают на необходимость разработки алгоритмов действий не только в условиях МО, оказывающей специализированную медицинскую помощь, но и амбулаторного ведения пациентов для оценки риска развития нежелательных явлений и, в конечном итоге, обеспечения эпидемиологической безопасности и повышения качества оказания медицинской помощи.
Список литературы
1. Капранова Н.И., Каширской Н.Ю. Муковисцидоз. М.: Медпрактика-М, 2014. 672 с.
2. Чернуха М.Ю., Шагинян И.А. Микробиология хронической инфекции легких у больных муковисцидозом. Муковисцидоз. М.: Медпрактика-М, 2014. С. 116-148.
3. Баранов А.А., Намазова-Баранова Л.С., Куцев С.И., Авдеев С.Н., Полевиченко Е.В., Белевский А.С., и др. Современные подходы к ведению детей с муковисцидозом. Педиатрическая фармакология 2022; 19(2): 153-195.
4. Горяинова А.В., Шумилов П.В., Каширская Н.Ю., Семык С.Ю. Роль дисплазии соединительной ткани в течении муковисцидоза у детей. Клинико-генетические аспекты. Российский вестник перинатологии и педиатрии 2018; 63(5): 20-28.
5. Lopes-Pacheco M. CFTR modulators: Shedding light on precision medicine for cystic fibrosis. Front Pharmacol 2016; (7): 275, doi: 10.3389/fphar.2016.00275
6. Аветисян Л. Р., Чернуха М. Ю., Шагинян И. А. и др. Антибиотикочувствительность Staphylococcus aureus, Pseudomonas aeruginosa и бактерий Burkholderia cepacia complex, персистирующих в легких больных муковисцидозом. Журнал эпидемиологии, микробиологии и иммунологии 2015; (6): 3-10.
7. De Boeck K. Cystic fibrosis in the year 2020: disease with a new face. Acta Paediatr 2020; 109(5): 893-899, doi: 10.1111/apa.15155
8. Шагинян И.А., Чернуха М.Ю., Аветисян Л.Р. и др. Эпидемиологические особенности хронической инфекции легких у больных муковисцидозом. Эпидемиология и вакцинопрофилактика 2017; 16 (6): 5-13.
9. Аветисян Л.Р., Чернуха М.Ю., Жуховицкий В.Г., Русакова Е.В., Бурмистров Е.М., Медведева О.С., и др. Микробиологический мониторинг хронической инфекции легких, вызванной Achromobacter SPP., у пациентов с муковисцидозом. Вопросы практической педиатрии 2022; 17(3): 26-32.
10. Stahl M., Steinke E., Mall M.A. Quantification of Phenotypic Variability of Lung Disease in Children with Cystic Fibrosis. Genes (Basel) 2021; 12(6): 803, doi: 10.3390/genes12060803
11. Баранов А.А., Намазова-Баранова Л.С., Куцев С.И., и др. Кистозный фиброз (муковисцидоз). Клинические рекомендации. М., 2020. 120 с.
12. Калюк А.Н. Методы бактериологического исследования условно-патогенных микроорганизмов в клинической микробиологии. Методические рекомендации Минздрава РСФСР. М., 1991.
13. Becker S.L., Berger F.K., Feldner S.K., Karliova I., Haber M., Mellmann A., Schäfers H.-J., Gärtner B. Outbreak of Burkholderia cepacia complex infections associated with contaminated octenidine mouthwash solution, Germany, August to September 2018. Euro Surveill. 2018; 23(42): 1800540, doi: 10.2807/1560-7917.ES.2018.23.42.1800540
14. Shaban R.Z., Sotomayor-Castillo C., Nahidi S., Li C., Macbeth D., Mitchell B.G., Russo P.L. Global burden, point sources, and outbreak management of healthcare-associated Burkholderia cepacia infections: An integrative review. Infect Control Hosp Epidemiol 2020; 41(7): 777-783, doi: 10.1017/ice.2020.184
15. «Об организации системы локального мониторинга антимикробной резистентности». Письмо Минздрава России от 25.05.2023 N 30-5/И/2-9190
16. Schaffer K. Epidemiology of infection and current guidelines for infection prevention in cystic fibrosis patients. J Hosp Infect 2015; 89(4): 309-313, doi: 10.1016/j.jhin.2015.02.005
17. Красовский С.А., Адян Т.А., Амелина Е.Л., Сергиенко Д.Ф., Шадрина В.В., Гущин М.Ю., Зоненко О.Г., Макарова М.А. Муковисцидоз: некоторые вопросы эпидемиологии и генетики. Практическая пульмонология 2019; (4): 45-50.
18. Фельдблюм И.В., Коза Н.М. Рецензия. Шкарин В.В., Ковалишена О.В. Новые инфекции: систематизация, проблемы, перспективы. Журнал микробиологии 2013, (4): 118-120.
19. Минулин И.Б., Швабский О.Р., Иванов И.В., Матыцин Н.О., Щеблыкина А.А., Таут Д.Ф. Обзор подходов к учету и анализу нежелательных событий при осуществлениии медицинской деятельности. Менеджер здравоохранения 2021; (3): 9-17.
Microbial Landscape of the Respiratory Tract of Children with Cystic Fibrosis: Monitoring Results
Authors
Mukhametzyanov A. M.
Doctor of Medicine, Chief Physician1; Assistant Professor, Head, Chair for Epidemiology2
Kaydanek T. V.
MD, PhD, Assistant Professor, Chair for Epidemiology2
Latypov A. A.
Clinical Resident, Chair for Epidemiology2
Valeeva D. S.
Deputy Chief Physician3
Ponomareva D. N.
MD, Epidemiologist3
Ermolenko I. A.
MD, Pulmonologist3
Gazizova A. G.
MD, Bacteriologist3
1 - Republican Clinical Infectious Diseases Hospital, Ufa, Russian Federation
2 - Bashkir State Medical University, Ufa, Russian Federation
3 - Republican Pediatric Clinical Hospital, Ufa, Russian Federation
Corresponding Author
Latypov Almaz Ayratovich; e-mail: almaz.latup@mail.ru
Conflict of interest
None declared.
Funding
The study had no sponsorship.
Abstract
Background. The article presents the results of microbiological monitoring of microorganisms of the respiratory tract of patients with cystic fibrosis (CF), changes in the spectrum, palette, and antibacterial resistance during repeated hospitalizations in a specialized hospital. Purpose of the study. To analyze the results of microbiological examination of respiratory tract biomaterial of children with CF hospitalized in a multidisciplinary pediatric hospital to optimize epidemiological surveillance at the local level. Materials and methods. The material for the study was the results of a microbiological study of smears from the pharynx, nose, or induced sputum of patients with cystic fibrosis observed at the Children's Center for Cystic Fibrosis (CF). Identification of isolated cultures was carried out by classical bacteriological methods. Subsequently, the isolated microorganisms were systematized to species. The analysis was carried out for 2019-2023. Determination of sensitivity to antibacterial drugs was carried out using the disk diffusion method. Indicators of the frequency (%) of isolation of various microorganisms and the frequency (%) of resistant microorganisms to the antimicrobial drugs used in a medical organization (MO) were calculated. A comparison was made of the frequency (%) and spectrum of isolated cultures during initial and subsequent hospitalizations at the Children's Cystic Fibrosis Center. Confidence intervals CI (95%) were calculated for relative values. Calculations were carried out using the epidemiological calculator Confidence Interval Calculator. Results. In the structure of isolated cultures from the biomaterial of the respiratory tract of children with cystic fibrosis, 45.4% were gram-negative microorganisms. During initial and subsequent hospitalizations, the highest frequency of isolation were Pseudomonas aeruginosa, Klebsiella pneumoniae, Stenotrophomonas maltophilia. Gram-positive microorganisms in the spectrum of isolated cultures amounted to 37.9%. The majority of the isolated gram-positive microorganisms are represented by Staphylococcus aureus (75.7%). During repeated hospitalizations to the Children's CF Center, based on the monitoring results, changes in the spectrum, frequency of isolation, and spectrum of resistance to antimicrobial drugs were determined. An increase in the frequency (p<0.05) of the isolation of Pseudomonas aeruginosa and Staphylococcus aureus was determined. During repeated hospitalizations, the frequency of isolation of associations of microorganisms increased from 50.5% CI [55.7; 45.3] to 81.4% CI [83.8; 79.0] (p<0.05). An increase in the frequency (p<0.05) of isolation of Pseudomonas aeruginosa strains resistant to reserve antibacterial drugs was determined by 3.2 times during subsequent hospitalizations. Conclusion. The revealed changes in the spectrum, frequency, palette and antibiotic resistance of microorganisms of the respiratory tract of CF patients at the local level of epidemiological surveillance indicate the need to develop algorithms of action in outpatient and inpatient management of CF patients to ensure epidemiologic safety of medical activity and improve the quality of medical care.
Key words
Cystic fibrosis, microbiological monitoring, chronic lung infection, antibiotic resistance, epidemiological risk, epidemiological surveillance
DOI
References
1. Kapranova N.I., Kashirskoy N.Yu. Mukoviscidoz. [Cystic fibrosis.] Moscow: Medpractika-M, 2014. (In Russ.)
2. Chernukha M.Yu., Shaginyan I.A. Mikrobiologiya hronicheskoj infekcii legkih u bol'nyh mukoviscidozom. Mukoviscidoz. [Microbiology of chronic lung infection in patients with cystic fibrosis. Cystic Fibrosis.] Moscow: Medpractika-M, 2014. P. 116-148. (In Russ.)
3. Baranov A.A., Namazova-Baranova L.S., Kutsev S.I., Avdeev S.N., Polevichenko E.V., Belevsky A.S., et al. Sovremennye podhody k vedeniyu detej s mukoviscidozom. [Modern approaches to the management of children with cystic fibrosis.] Pediatricheskaya farmakologiya [Pediatric Pharmacology] 2022; 19(2): 153-195. (In Russ.)
4. Goryainova A.V., Shumilov P.V., Kashirskaya N.Yu., Semyk S.Yu. Rol' displazii soedinitel'noj tkani v techenii mukoviscidoza u detej. Kliniko-geneticheskie aspekty. [The role of connective tissue dysplasia in the course of cystic fibrosis in children. Clinical and genetic aspects.] Rossijskij vestnik perinatologii i pediatrii [Russian Bulletin of Perinatology and Pediatrics] 2018; 63(5): 20-28. (In Russ.)
5. Lopes-Pacheco M. CFTR modulators: Shedding light on precision medicine for cystic fibrosis. Front Pharmacol 2016; (7): 275, doi: 10.3389/fphar.2016.00275
6. Avetisyan L.R., Chernukha M.Yu., Shaginyan I.A., et al. Antibiotikochuvstvitel'nost' Staphylococcus aureus, Pseudomonas aeruginosa i bakterij Burkholderia cepacia complex, persistiruyushchih v legkih bol'nyh mukoviscidozom. [Antibiotic sensitivity of Staphylococcus aureus, Pseudomonas aeruginosa and Burkholderia cepacia complex bacteria persisting in the lungs of patients with cystic fibrosis.] Zhurnal epidemiologii, mikrobiologii i immunologii [Journal of Epidemiology, Microbiology and Immunology] 2015; (6): 3-10. (In Russ.)
7. De Boeck K. Cystic fibrosis in the year 2020: disease with a new face. Acta Paediatr 2020; 109(5): 893-899, doi: 10.1111/apa.15155
8. Shaginyan I.A., Chernukha M.Yu., Avetisyan L.R., et al. Epidemiologicheskie osobennosti hronicheskoj infekcii legkih u bol'nyh mukoviscidozom. [Epidemiological features of chronic lung infection in patients with cystic fibrosis.] Epidemiologiya i vakcinoprofilaktika [Epidemiology and Vaccinal Prevention] 2017; 16 (6): 5-13. (In Russ.)
9. Avetisyan L.R., Chernukha M.Yu., Zhukhovitsky V.G., Rusakova E.V., Burmistrov E.M., Medvedeva O.S., et al. Mikrobiologicheskij monitoring hronicheskoj infekcii legkih, vyzvannoj Achromobacter SPP., u pacientov s mukoviscidozom. [Microbiological monitoring of chronic lung infection caused by Achromobacter spp., in patients with cystic fibrosis.] Voprosy prakticheskoj pediatrii [Questions of practical pediatrics] 2022; 17(3): 26-32. (In Russ.)
10. Stahl M., Steinke E., Mall M.A. Quantification of Phenotypic Variability of Lung Disease in Children with Cystic Fibrosis. Genes (Basel) 2021; 12(6): 803, doi: 10.3390/genes12060803.
11. Baranov A.A., Namazova-Baranova L.S., Kutsev S.I., et al. Kistoznyj fibroz (mukoviscidoz). Klinicheskie rekomendacii. [Clinical guidelines «Cystic fibrosis».] Moscow, 2020. (In Russ.)
12. Kalyuk A.N. Metody bakteriologicheskogo issledovaniya uslovno-patogennyh mikroorganizmov v klinicheskoj mikrobiologii. [Methods of bacteriological research of opportunistic microorganisms in clinical microbiology.] Metodicheskie rekomendacii Minzdrava RSFSR. [Methodological recommendations of the Ministry of Health of the RSFSR.] Moscow, 1991. (In Russ.)
13. Becker S.L., Berger F.K., Feldner S.K., Karliova I., Haber M., Mellmann A., Schäfers H.-J., Gärtner B. Outbreak of Burkholderia cepacia complex infections associated with contaminated octenidine mouthwash solution, Germany, August to September 2018. Euro Surveill. 2018; 23(42): 1800540, doi: 10.2807/1560-7917.ES.2018.23.42.1800540
14. Shaban R.Z., Sotomayor-Castillo C., Nahidi S., Li C., Macbeth D., Mitchell B.G., Russo P.L. Global burden, point sources, and outbreak management of healthcare-associated Burkholderia cepacia infections: An integrative review. Infect Control Hosp Epidemiol 2020; 41(7): 777-783, doi: 10.1017/ice.2020.184
15. Ob organizacii sistemy lokal'nogo monitoringa antimikrobnoj rezistentnosti. [On the organization of a system for local monitoring of antimicrobial resistance.] Pis'mo Minzdrava Rossii ot 25.05.2023 N 30-5/I/2-9190. [Letter of the Ministry of Health of Russia of May 25, 2023 N 30-5/I/2-9190.] (In Russ.)
16. Schaffer K. Epidemiology of infection and current guidelines for infection prevention in cystic fibrosis patients. J Hosp Infect 2015; 89(4): 309-313, doi: 10.1016/j.jhin.2015.02.005
17. Krasovsky S.A., Adyan T.A., Amelina E.L., Sergienko D.F., Shadrina V.V., Gushchin M.Yu., Zonenko O.G., Makarova M.A. Cystic fibrosis: some issues of epidemiology and genetics. [Mukoviscidoz: nekotorye voprosy epidemiologii i genetiki.] Prakticheskaya pul'monologiya [Practical pulmonology] 2019; (4): 45-50. (In Russ.)
18. Feldblum I.V., Koza N.M. Review on: Shkarin V.V., Kovalishena O.V. Novye infekcii: sistematizaciya, problemy, perspektivy. [New infections: systematization, problems, prospects.] Zhurnal mikrobiologii [Journal of Microbiology] 2013, (4): 118-120. (In Russ.)
19. Minulin I.B., Shvabsky O.R., Ivanov I.V., Matytsin N.O., Shcheblykina A.A., Taut D.F. Obzor podhodov k uchetu i analizu nezhelatel'nyh sobytij pri osushchestvleniii medicinskoj deyatel'nosti. [Review of approaches to recording and analyzing adverse events in medical activities.] Menedzher zdravoohraneniya [Healthcare Manager] 2021; (3): 9-12.