Авторы
Петухов А. Е.
к.фарм.н., заведующий химико-токсикологической лабораторией Референс-центра по мониторингу потребления психоактивных веществ1; доцент, кафедра фармацевтической и токсикологической химии им. А. П. Арзамасцева Института фармации им. А. П. Нелюбина2
Мельник Е. В.
к.фарм.н., руководитель, научно-образовательный исследовательский центр «ФАРМА-ПРЕМИУМ» Института фармации им. А.П. Нелюбина2
Надеждин А. В.
к.м.н., ведущий научный сотрудник1; доцент3
Тетенова Е. Ю.
к.м.н., ведущий научный сотрудник1
Суханова А. М.
к.фарм.н., химик-эксперт медицинской организации химико-токсикологической лаборатории Референс-центра по мониторингу потребления психоактивных веществ1; старший преподаватель кафедры фармацевтической и токсикологической химии им. А.П. Арзамасцева Института фармации им. А.П. Нелюбина2
Панкратенко Е. П.
медицинский лабораторный техник (фельдшер-лаборант) химико-токсикологической лаборатории Референс-центра по мониторингу потребления психоактивных веществ1
Кошкина Е. А.
д.м.н., профессор, главный научный сотрудник1
1ГБУЗ «Московский научно-практический центр наркологии», г. Москва, Российская Федерация
2ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), г. Москва, Российская Федерация
3ФГБОУ ДПО Российская медицинская академия непрерывного профессионального образования Минздрава России, г. Москва, Российская Федерация
Автор для корреспонденции
Петухов Алексей Евгеньевич; e-mail: a-l-e-x4@yandex.ru.
Финансирование
Исследование не имело спонсорской поддержки.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Аннотация
Введение. Фосфатидилэтанол (PEth) представляет собой фосфолипид, медленно образующийся в клеточных мембранах в результате ферментативной реакции между фосфатидилхолином и этанолом, катализируемой фосфолипазой D. Опубликованные в литературе методики определения фосфатидилэтанола применяют высокоэффективную жидкостную хроматографию с масс-спектрометрическим детектированием как метод, обладающий высокой специфичностью, точностью, прецизионностью и возможностью определения веществ в минимальных концентрациях, что является основополагающим для клинической лабораторной диагностики при осуществлении мониторинга злоупотребления алкоголем населением. Цель. Цель исследования заключалась в разработке и валидации методики количественного определения прямого маркера злоупотребления алкоголем фосфатидилэтанола в крови человека. Материалы и методы. Количественное определение фосфолипида проводили методом высокоэффективной жидкостной хроматографии с тандемной масс-спектрометрией. Результаты исследования и их обсуждения. Разработанная методика была валидирована по параметрам: селективность, нижний предел количественного определения, линейность, перенос пробы, точность, прецизионность, эффект матрицы, стабильность. Аналитический диапазон составил 0.0025 мкмоль/л – 3.0 мкмоль/л; уровень НПКО PEth 16:0/18:1 был равен 0.0025 мкмоль/л. Выводы. Разработанная методика количественного определения фосфатидилэтанола пригодна для применения в лабораторной диагностике с целью проведения популяционного мониторинга при анализе злоупотребления алкоголем.
Ключевые слова
биомаркеры злоупотребления алкоголем, фосфатидилэтанол, ВЭЖХ-МС/МС, валидация
Для цитирования
Петухов А. Е., Мельник Е. В., Надеждин А. В., Тетенова Е. Ю., Суханова А. М., Панкратенко Е. П., Кошкина Е. А. Разработка и валидация методики количественного определения фосфатидилэтанола в цельной крови. Медицина 2022; 10(3): 1-12.
DOI
Введение
На сегодняшний день проблема высокой летальности по причине острой алкогольной интоксикации и хронического алкоголизма занимает одну из лидирующих позиций в России [1]. В связи с этим актуальным и перспективным является определение прямого биомаркера злоупотребления алкоголем, фосфатидилэтанола (PEth), благодаря его высокой чувствительности и специфичности среди других биомаркеров злоупотребления алкоголем (прямых и непрямых) в рамках лабораторной диагностики [2].
Потребление этанола приводит к появлению PEth в тканях вследствие образования фосфатидилового спирта в результате реакции трансфосфатидилирования под действием фермента фосфолипазы D на фосфатидилхолин и воду в качестве субстратов [3]. В норме фосфатидилхолин превращается в фосфатидную кислоту [4].
Средний период полураспада PEth варьируется от 3 до 12 дней. Концентрация фосфатидилэтанола в крови ≥211 нг/мл (300 нмоль/л) указывает на злоупотребление алкоголем, тогда как концентрация PEth ≤21 нг/мл (≤30 нмоль/л) указывает на низкое потребление алкоголя [5].
В настоящее время определение фосфатидилэтанола в крови проводят с помощью метода высокоэффективной жидкостной хроматографии (ВЭЖХ) с тандемным масс-спектрометрическим детектированием благодаря высокой чувствительности и специфичности метода. В литературных источниках описаны методики определения PEth методом жидкостной хроматографии – тандемной масс-спектрометрии (ВЭЖХ-МС/МС) с электроспрейной ионизацией как способ идентификации различных гомологов исследуемого фосфолипида [6]. Кроме того, используют методы жидкостной хроматографии с масс-спектрометрией высокого разрешения, ультра-ВЭЖХ-МС/МС, метод неводного капиллярного электрофореза [7-12].
Как правило, основным методом пробоподготовки является жидкость-жидкостная экстракция (ЖЖЭ) с использованием в качестве растворителей изопропанола и гексана, также описаны методики, использующие осаждение белков и твердофазную экстракцию [12-14]. Описан метод 96-ти лунок для быстрого получения более чистых экстрактов [15].
Цель исследования
Цель исследования состояла в разработке и валидации методики количественного определения фосфатидилэтанола в цельной крови для применения в лабораторно-диагностической практике с целью контроля лиц групп риска по злоупотреблению, ремиссии алкоголизма и рецидивов.
Материалы и методы
Хроматографирование и детектирование проводили на высокоэффективном жидкостном хроматографе Agilent 1260 (Agilent Technologies, Калифорния, США), оснащенном градиентным насосом G1312B, дегазатором G4225A, автосамплером G1329B, термостатом колонок G1316A и тандемным масс-селективным детектором Agilent 6460 (Agilent Technologies, Калифорния, США) с источником ионизации Jet Stream Electrospray Ionization.
Для исследования были использованы следующие реактивы: PEth 16:0/18:1 (Avanti Polar Lipids, Алабастер, Алабама, США), PEth 16:0/18:1-d5 – внутренний стандарт (ВС) данного исследования (Echelon Biosciences, Солт-Лейк-Сити, США). Метил-трет-бутиловый эфир (MTBE, Merck, Дармштадт, Германия), метанол (HPLC-grade, Scharlau, Сентменат, Испания), ацетонитрил (ACN, HPLC-grade, Acros Organics, Гел, Бельгия), кислота муравьиная, 2-пропанол (IPA) и аммония формиат были приобретены в Sigma-Aldrich (HPLC-grade, Штайнхайм, Германия). Вода высокого качества была получена в лаборатории при помощи системы очистки воды Milli-Q, Merck KGaA (Дармштадт, Германия).
Исходные стандартные растворы PEth и ВС готовили растворением навесок в метаноле; рабочие стандартные растворы – разведением и смешиваем исходных стандартных растворов.
Исходные стандартные растворы хранили при температуре -50° C, а рабочие стандартные растворы при +4° C.
Пробоподготовка
Для определения фосфатидилэтанола в цельной крови, 100 мкл крови помещали в пробирку типа Эппендорф, добавляли 100 мкл деионизированной воды, 50 мкл смеси 2-пропанола и ацетонитрила 1:1 (IPA:ACN 1:1), 25 мкл внутреннего стандарта PEth-D5с концентрацией 1129 нг/мл, 500 мкл смеси метил-третбутилового эфира и 2-пропанола 4:1 (MTBE/IPA 4:1), встряхивали на Вортексе в течение 30 секунд. Затем центрифугировали при 14500 об/мин в течение 10 минут при температуре 4° С. Надосадочный органический слой объемом 450 мкл переносили в виалу на 2 мл, выпаривали в шкафу для выпаривания при температуре не выше 40° С, затем добавляли 100 мкл смеси 2-пропанола и ацетонитрила 1:1 (IPA:ACN 1:1), переносили в коническую вставку, закрывали виалу для проведения дальнейшего анализа.
Условия хроматографического разделения и детектирования
Условия хроматографирования и детектирования были подобраны экспериментально.
Для проведения исследования использовали хроматографическую колонку Zorbax Eclipse Plus C18 RRHD (1.8 мкм, 2.1 x 50мм) с предколонкой Zorbax Eclipse Plus C18 (1.8 мкм, 12,5 x 2.1мм) (Agilent Technologies, Калифорния, США). Температура термостата колонок составляла 50° С. В качестве подвижной фазы применяли элюент А (10 мМ водный раствор формиата аммония/ацетонитрил, (20:80, v:v)) и элюент В (2-пропанол) в градиентном режиме элюирования (табл. 1) со скоростью потока 0,4 мл/мин и объемом вводимой пробы 5 мкл. Время анализа для каждого образца составило 11 минут. ВЭЖХ-МС/МС параметры для PEth и внутреннего стандарта PEth-d5 указаны в таблице 2.
Таблица 1. Градиент состава подвижной фазы
| Время анализа, мин | Объемная доля элюента А, % | Объемная доля элюента В, % |
| 0.00 | 90.0 | 10.0 |
| 0.01 | 50.0 | 50.0 |
| 2.00 | 50.0 | 50.0 |
| 3.00 | 0.0 | 100.0 |
| 5.00 | 0.0 | 100.0 |
| 6.00 | 90.0 | 10.0 |
Таблица 2. ВЭЖХ-МС/МС параметры
| Аналит | Время удерживания (мин) | MRM переходы | Напряжение на фрагменторе (В) | Энергия в ячейке соударения (В) | Время выдержки (мс) |
| PEth 16:0/18:1 | 3.6 | 701.8 → 281.3 | 239 | 29 | 200 |
| 701.8 → 255.3 | 37 | ||||
| PEth 16:0/18:1-d5 (ВС) | 3.6 | 706.8 → 281.3 | 239 | 29 | 200 |
| 706.8 → 255.3 | 37 |
Результаты и обсуждение
Валидация методики
Валидация биоаналитической методики была проведена на основе руководства FDA по следующим параметрам: селективность; нижний предел количественного определения (НПКО); линейность; перенос пробы, точность, прецизионность, эффект матрицы, стабильность (внутри- и межлабораторная) [17].
Селективность
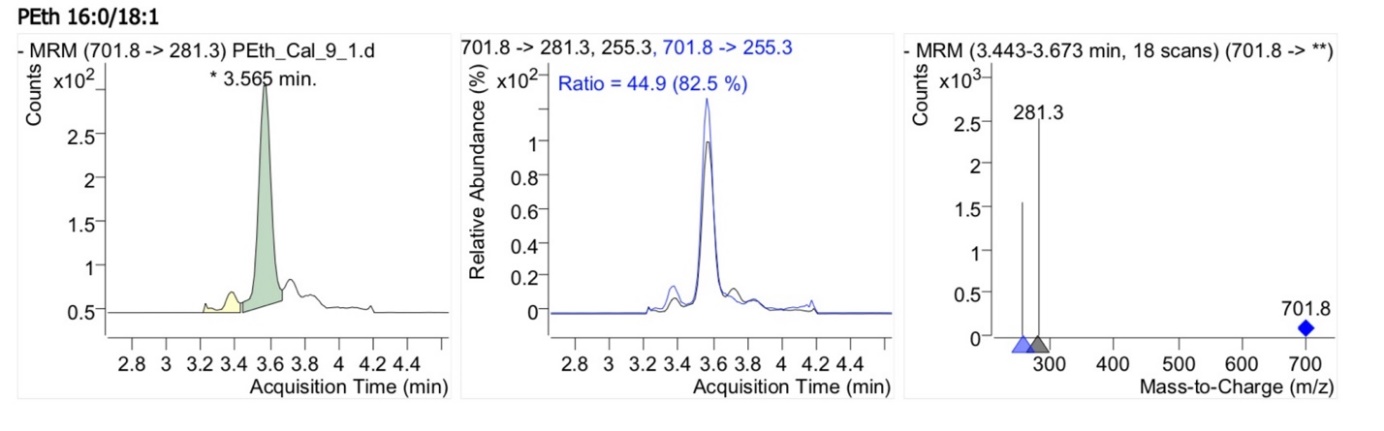
Селективность оценивалась путем сравнения хроматограмм образца холостой биологической матрицы с хроматограммой образца НПКО, содержащего PEth 16:0/18:1 (0.0025 мкмоль/л) и PEth 16:0/18:1-d5 (1.6 мкмоль/л) (рис. 1,2).
Рис. 1. Хроматограмма PEth 16:0/18:1 и PEth 16:0/18:1-d5 в цельной крови – холостой биологической матрице.
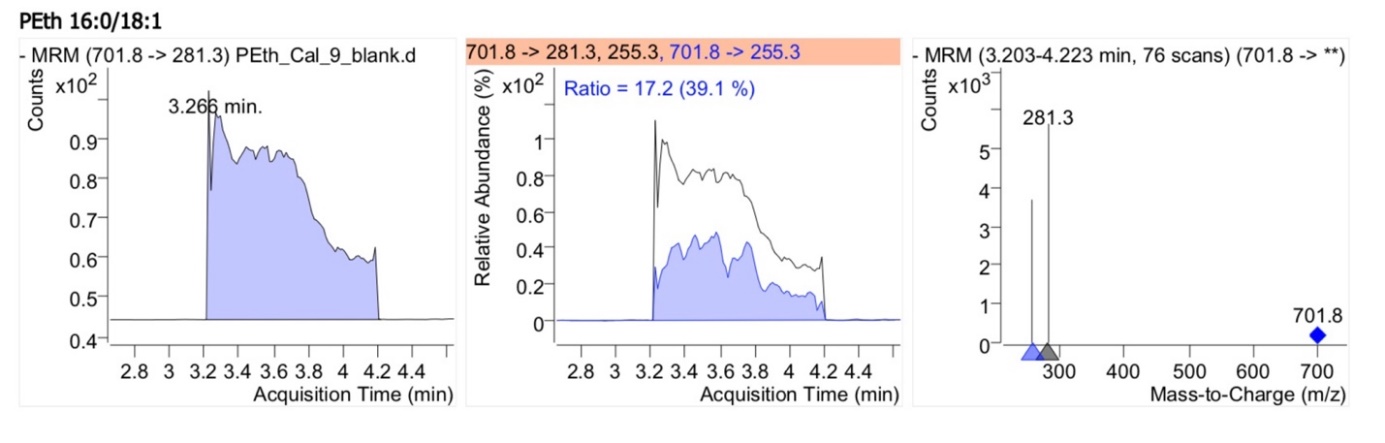
Рис. 2. Хроматограмма PEth 16:0/18:1 и PEth 16:0/18:1-d5 в цельной крови – биологическая матрица с прибавлением растворов рабочего и внутреннего стандартов.
Нижний предел количественного определения и линейность
Линейность подтверждалась в диапазоне концентраций от 0.0025 мкмоль/л до 3.0 мкмоль/л. По полученным значениям был построен калибровочный график в координатах отношение площади пика аналита соответственно к площади пика ВС от отношения концентрации аналита. НПКО методики определяли на основании данных линейности, точности и прецизионности. За НПКО методики принималась минимальная концентрация PEth 16:0/18:1 в цельной крови в диапазоне линейной зависимости, которую можно было количественно определить с приемлемой прецизионностью и точностью, которая составила 0.0025 мкмоль/л. Отношение сигнал/шум по пикам PEth 16:0/18:1, рассчитанное при помощи программного обеспечения Mass Hunter, составило более 10:1.
Калибровочная кривая носила линейный характер во всем диапазоне определяемых концентраций 0.0025 мкмоль/л – 3.0 мкмоль/л. Полученный коэффициент корреляции соответствовалкритерию пригодности (не менее 0,99) (рис. 3). Относительная погрешность измерений для калибровочных образцов составила не более 20% для НПКО и не более 15% для остальных точек от номинальных значений.
Рис. 3. Калибровочный график №1 зависимости отношения площади пика PEth 16:0/18:1 к площади пика PEth 16:0/18:1-d5 от концентрации PEth 16:0/18:1.
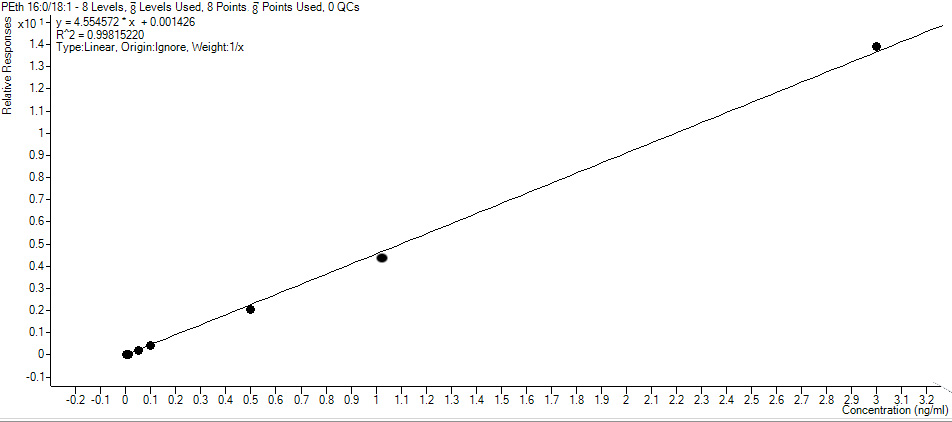
Отклонения концентраций калибровочных образцов, рассчитанные по уравнению линейной зависимости от номинальных значений, приведены в таблице 3.
Таблица 3. Отклонения концентраций PEth 16:0/18:1 в калибровочных образцах от их номинальных значений, калибровочный график №1
| Концентрация, номинальная, мкмоль/л | Концентрация, рассчитанная, мкмоль/л | Е, % | Норма, не более % |
| 0,0025 | 0,0029 | 16,00 | 20 |
| 0,005 | 0,0054 | 8,00 | 15 |
| 0,01 | 0,0093 | -7,00 | 15 |
| 0,05 | 0,0469 | -6,20 | 15 |
| 0,1 | 0,0971 | -2,90 | 15 |
| 0,5 | 0,4492 | -10,16 | 15 |
| 1 | 0,9153 | -8,47 | 15 |
| 3 | 3,0567 | 1,89 | 15 |
Перенос пробы
Перенос PEth 16:0/18:1 оценивался при последовательном анализе проб с концентрацией PEth 16:0/18:1 3 мкмоль/л и чистой цельной крови. В результате последовательного анализа на хроматограмме чистой крови отсутствовали пики, соответствующие по времени удерживания PEth 16:0/18:1. Таким образом, перенос пробы не наблюдался.
Точность и прецизионность
Анализ точности и прецизионности методики внутри цикла проводили с использованием пяти образцов холостой цельной крови (n=5) с добавлением рабочих стандартных растворов PEth 16:0/18:1 до получения концентраций 0.0025, 0.0075, 1.5, 2.25 мкмоль/л (QCA, QCB, QCC, QCD). Анализ точности и прецизионности методики между циклами проводили на этих же 4 уровнях концентрации PEth 16:0/18:1 между циклами за три различных дня (n=15). Полученные величины относительного стандартного отклонения (RSD, %) и относительной погрешности (Е, %) соответствуют нормам (не более 20% на уровне НПКО, не более 15% – для остальных точек). Полученные результаты позволяют считать методику точной и прецизионной при определении PEth 16:0/18:1 в цельной крови (табл. 4,5).
Таблица 4. Прецизионность и точность методики определения PEth 16:0/18:1 в цельной крови внутри аналитического цикла (n=5)
| Концентрация, номинальная, мкмоль/л | Концентрация, рассчитанная, мкмоль/л | RSD, % | E, % |
| 0,0025 | 0,0030 ± 0,0001 | 4,38 | 19,20 |
| 0,0075 | 0,0072 ± 0,0000 | 0,00 | -4,00 |
| 1,5 | 1,6203 ± 0,0051 | 0,31 | 8,02 |
| 2,25 | 2,2403 ± 0,0061 | 0,27 | -0,43 |
Таблица 5. Прецизионность и точность методики определения PEth 16:0/18:1 в цельной крови между аналитическими циклами (n=15)
| Концентрация, номинальная, мкмоль/л | Концентрация, рассчитанная, мкмоль/л | RSD, % | E, % |
| 0,0025 | 0,0029 ± 0,0001 | 5,00 | 14,93 |
| 0,0075 | 0,0072 ± 0,0001 | 1,72 | -4,44 |
| 1,5 | 1,5518 ± 0,0523 | 3,37 | 3,46 |
| 2,25 | 2,2883 ± 0,0408 | 1,78 | 1,70 |
Эффект матрицы
Эффект матрицы (МЕ) был оценен на нижнем и верхнем уровнях диапазона линейности PEth 16:0/18:1 (0.0075 мкмоль/л и 2.25 мкмоль/л). Значения МЕ, а также МЕ, нормализованного по ВС, для нижнего уровня концентраций составили 95% и 102%, соответственно; для верхнего уровня – 91% и 98%, соответственно. Рассчитанные значения ME удовлетворяют критериям приемлемости.
Стабильность
Проведенные исследования на образцах цельной крови показали, что PEth 16:0/18:1 стабилен при различных условиях хранения. Была показана стабильность PEth 16:0/18:1 при хранении в течение 6 часов при комнатной температуре. Помимо этого, было подтверждено, что хранение при температуре -20° С в течение 4 недель, а также 3 цикла заморзки-разморозки не влияют на стабильность PEth 16:0/18:1.
Заключение
Разработана и валидирована методика количественного определения фосфатидилэтанола в плазме крови методом ВЭЖХ-МС/МС. Аналитический диапазон методики составил 0.0025 мкмоль/л – 3.0 мкмоль/л; уровень НПКО PEth 16:0/18:1 был равен 0.0025 мкмоль/л. Данная методика пригодна для использования в лабораторно-диагностической практике с целью контроля лиц групп риска по злоупотреблению, ремиссии алкоголизма и рецидивам.
Список литературы
1. Халимова Ю.С., Шокиров Б.С. Морфофункциональные особенности внутренних органов при хроническом алкоголизме. Научный прогресс 2022; 3 (2): 782-789.
2. Петухов А.Е., Надеждин А.В., Богстранд С.Т., Брюн Е.А., Раменская Г.В., Кошкина Е.А., Мельник Е.В., Смирнов А.В., Тетенова Е.Ю. Фосфатидилэтанол как биомаркер злоупотребления алкоголем. Наркология 2017; (2): 42-47.
3. Aradottir S., Olsson B.L., Methodological modifications on quantification of phosphatidylethanol in blood from humans abusing alcohol, using high-performance liquid chromatography and evaporative light scattering detection. BMC Biochemistry 2005; (6): 18, doi: 10.1186/1471-2091-6-18
4. Литвинова Е.С., Сорокин А.В., Долгарева С.А., Бушмина О.Н., Харченко А.В., Конопля Н.А. Белки и липиды мембраны эритроцитов при острой и хронической алкогольной интоксикации. Современные проблемы науки и образования 2017; (2): 115.
5. Hahn J.A., Anton R.F., Javors M.A. The formation, elimination, interpretation, and future research needs of phosphatidylethanol for research studies and clinical practice. Alcoholism: Clinical and Experimental Research 2016; 40(11): 2292‐2295.
6. Петухов А.Е., Надеждин А.В., Bogstrand S.T., Брюн А.Е., Раменская Г.В., Кошкина Е.А., Мельник Е.В., Смирнов А.В., Тетенова Е.Ю. Сравнительный анализ методик определения фосфатидилэтанола в крови как биомаркера злоупотребления алкоголем. Судебно-медицинская экспертиза 2017; (5): 23-26, doi: 10.17116/sudmed201760523-26
7. Nalesso A., Viel G., Cecchetto G., Mioni D., Pessa G., Favretto D., Ferrara S.D. Quantitative profiling of phosphatidylethanol molecular species in human blood by liquid chromatography high resolution mass spectrometry. Journal of Chromatography A. 2011; 1218:8423-8431, doi: 10.1016/j.chroma.2011.09.068
8. Kwak H.S., Han J.Y., Ahn H.K., Kim M.H., Ryu H.M., Kim M.Y., Chung H.J., Cho D.H., Shin C.Y., Velazquez-Armenta E.Y., Nava-Ocampo A.A. Blood levels of phosphatidylethanol in pregnant women reporting positive alcohol ingestion, measured by an improved LC-MS/MS analytical method. Clinical Toxicology 2012; 50(10): 886-891, doi: 10.3109/15563650.2012.744997
9. Kummer N., Ingels A.S., Wille S.M., Hanak C., Verbanck P., Lambert W.E., Samyn N., Stove C.P. Quantification of phosphatidylethanol 16:0/18:1, 18:1/18:1, and 16:0/16:0 in venous blood and venous and capillary dried blood spots from patients in alcohol withdrawal and control volunteers. Analytical and Bioanalytical Chemistry 2016; 408(3): 825-838, doi: 10.1007/s00216-015-9169-1
10. Nalesso A., Viel G., Cecchetto G., Frison G., Ferrara S.D. Analysis of the alcohol biomarker phosphatidylethanol by NACE with on-line ESI-MS. Electrophoresis 2010; 31(7): 1227-1233, doi: 10.1002/elps.200900430
11. Oppolzer D., Barroso M., Gallardo E. Bioanalytical procedures and developments in the determination of alcohol biomarkers in biological specimens. Bioanalysis 2016; 8(3): 229-251, doi: 10.4155/bio.15.240
12. Luginbühl M., Stöth F., Schröck A., Gaugler S., Weinmann W. Quantitative determination of phosphatidylethanol in dried blood spots for monitoring alcohol abstinence. Nature Protocols 2021; 16(1): 283-308, doi: 10.1038/s41596-020-00416
13. Zhang X., Zheng F., Lin Z., Johansen S., Yu T., Liu Y., Huang Z., Li J., Yan J., Rao Y. Simultaneous determination of ethanol's four types of non‐oxidative metabolites in human whole blood by liquid chromatography tandem mass spectrometry. Analytica Chimica Acta 2017; 963:68‐75, doi: 10.1016/j.aca.2017.01.040
14. Duarte M., Jagadeesan K.K., Billing J., Yilmaz E., Laurell T., Ekstrom S. Solid‐phase extraction of the alcohol abuse biomarker phosphatidylethanol using newly synthesized polymeric sorbent materials containing quaternary heterocyclic groups. Journal of Chromatography A 2017; 1519:1‐8, doi: 10.1016/j.chroma.2017.08.051
15. Berg T., Eliassen E., Jorgenrud B., Kabashi S., Petukhov A.E., Bogstrand S.T. Determination of phosphatidylethanol 16:0/18:1 in whole blood by 96‐well supported liquid extraction and UHPLC‐MS/MS. Journal of Clinical Laboratory Analysis 2019; 33, doi: 10.1002/jcla.22631
16. White D., O'Halloran S.J., Salman S.M., Macquillan G., Joyce D.A. Validation of a liquid chromatography tandem mass spectrometry (LC-MS/MS) method for erythrocyte phosphatidylethanol revealing critical considerations for its use as a clinical biomarker. Journal of chromatography B, Analytical technologies in the biomedical and life sciences 2022; 1192: 123134, doi: 10.1016/j.jchromb.2022.123134
17. Food and Drug Administration, Guidance for Industry: Bioanalytical Method Validation, U.S. Dep Heal. Hum. Serv. 2001, P. 4–10. [Электронный ресурс] Режим доступа: http://www.labcompliance.de/documents/FDA/FDA-Others/Laboratory/f-507-bioanalytical-4252fnl.pdf (дата обращения 14.09.2022).
Development and Validation of a Method for Quantitative Determination of Phosphatidylethanol in Whole Blood
Authors
Petukhov A. E.
PhD (Pharmacy), Head, Chemical and Toxicological Laboratory of the Reference Center for Monitoring the Use of Psychoactive Substances1; Assistant Professor, A.P. Arzamastsev Chair for Pharmaceutical and Toxicological Chemistry of A.P. Neljubin Institute for Pharmacy2
Mel’nik E. V.
PhD (Pharmacy), Head, scientific and educational research center «PHARMA-PREMIUM», A.P. Neljubin Institute for Pharmacy2
Nadezhdin A. V.
MD, PhD, Leading Researcher1; Assistant Professor3
Tetenova E. J.
MD, PhD, Leading Researcher1
Sukhanova A. M.
PhD (Pharmacy), Chemist-Expert, Chemical-Toxicological Laboratory of the Reference Center for Monitoring the Use of Psychoactive Substances1; Senior Lecturer A.P. Arzamastsev Chair for Pharmaceutical and Toxicological Chemistry of A.P. Neljubin Institute for Pharmacy2
Pankratenko E. P.
Medical Laboratory Technician, Chemical-Toxicological Laboratory of the Reference Center for Monitoring the Use of Psychoactive Substances1
Koshkina E. A.
Doctor of Medicine, Professor, Head Researcher1
1 - Moscow Research and Practical Centre on Addictions of Moscow Department of Public Health, Moscow, Russian Federation
2 - Sechenov First Moscow State Medical University, Moscow, Russian Federation
3 - Russian Medical Academy of Continuous Professional Education, Moscow, Russian Federation
Corresponding Author
Petukhov Aleksei; e-mail: a-l-e-x4@yandex.ru.
Funding
The study had no sponsorship.
Conflict of interest
None declared.
Abstract
Introduction. Phosphatidylethanol (PEth) is a phospholipid slowly forming in cell membranes as a result of the phospholipase D enzymatic reaction between phosphatidylcholine and ethanol. As a result of the analysis of published scientific papers, high performance liquid chromatography with mass spectrometric detection is used to determine phosphatidylethanol as a method with high specificity, accuracy, precision and the ability to determine substances at minimum concentrations, which is fundamental for clinical laboratory diagnostics when monitoring alcohol abuse in the population. Aim. The aim of the study was to develop and validate a method for the quantitative determination of a direct marker of alcohol abuse, phosphatidylethanol, in human blood. Materials and methods. Phospholipid was quantified by high performance liquid chromatography with tandem mass spectrometry. Results of the study and their discussion. The developed method was validated for the following parameters: selectivity, lower limit of quantitation, linearity, sample transfer, accuracy, precision, matrix effect, stability. The analytical range was 0.0025 µmol/L – 3.0 µmol/L; LPCO level PEth 16:0/18:1 0.0025 was equal to µmol/l. Conclusions. The developed method for the quantitative determination of phosphatidylethanol is suitable for use in laboratory diagnostics in order to monitor the population in the analysis of alcohol abuse.
Key words
alcohol abuse biomarkers, phosphatidylethanol, HPLC-MS/MS, validation
DOI
References
1. Halimova Ju.S., Shokirov B.S. Morfofunkcional'nye osobennosti vnutrennih organov pri hronicheskom alkogolizme. [Morphofunctional features of internal organs in chronic alcoholism]. Nauchnyj progress [Scientific progress (Russian Federation)] 2022; 3 (2): 782-789. (In Russ.)
2. Petuhov A.E., Nadezhdin A.V., Bogstrand S.T., Bryun E.A., Ramenskaja G.V., Koshkina E.A., Mel'nik E.V., Smirnov A.V., Tetenova E.Ju. Fosfatidiljetanol kak biomarker zloupotreblenija alkogolem [Phosphatidylethanol as the new alcohol abuse biomarker]. Narkologija [Narcology] 2017; (2): 42-47. (In Russ.)
3. Aradottir S., Olsson B.L. Methodological modifications on quantification of phosphatidylethanol in blood from humans abusing alcohol, using high-performance liquid chromatography and evaporative light scattering detection. BMC Biochemistry 2005; (6): 18, doi: 10.1186/1471-2091-6-18
4. Litvinova E.S., Sorokin A.V., Dolgareva S.A., Bushmina O.N., Kharchenko A.V., KonoplyaN.A. Belki I lipidy membrany jeritrocitov pri ostroj I hronicheskoj alkogol'noj intoksikacii [Proteins and lipids of the erythrocyte membrane in acute and chronic alcohol intoxication]. Sovremennye problem nauki I obrazovanija [Modern problems of science and education] 2017; (2): 115. (In Russ.)
5. Hahn J.A., Anton R.F., Javors M.A. The formation, elimination, interpretation, and future research needs of phosphatidylethanol for research studies and clinical practice. Alcoholism: Clinical and Experimental Research 2016; 40(11): 2292‐2295.
6. Petuhov A.E., Nadezhdin A.V., Bogstrand S.T., Bryun A.E., Ramenskaja G.V., Koshkina E.A., Mel'nik E.V., Smirnov A.V., Tetenova E.Ju. Sravnitel'nyj analiz metodik opredelenija fosfatidiljetanola v krovi kak biomarkera zloupotreblenija alkogolem [The comparative analysis of the methods for the determination of phosphatidylethanol in blood as a biological marker of alcohol abuse]. Sudebno-medicinskaja ekspertiza [Forensic-medical Examination] 2017; (5): 23-26, doi: 10.17116/sudmed201760523-26 (In Russ.)
7. Nalesso A., Viel G., Cecchetto G., Mioni D., Pessa G., Favretto D., Ferrara S.D. Quantitative profiling of phosphatidylethanol molecular species in human blood by liquid chromatography high resolution mass spectrometry. Journal of Chromatography A 2011; 1218:8423-8431, doi: 10.1016/j.chroma.2011.09.068
8. Kwak H.S., Han J.Y., Ahn H.K., Kim M.H., Ryu H.M., Kim M.Y., Chung H.J., Cho D.H., Shin C.Y., Velazquez-Armenta E.Y., Nava-Ocampo A.A. Blood levels of phosphatidylethanol in pregnant women reporting positive alcohol ingestion, measured by an improved LC-MS/MS analytical method. Clinical Toxicology 2012; 50(10): 886-891, doi: 10.3109/15563650.2012.744997.
9. Kummer N., Ingels A.S., Wille S.M., Hanak C., Verbanck P., Lambert W.E., Samyn N., Stove C.P. Quantification of phosphatidylethanol 16:0/18:1, 18:1/18:1, and 16:0/16:0 in venous blood and venous and capillary dried blood spots from patients in alcohol withdrawal and control volunteers. Analytical and Bioanalytical Chemistry 2016; 408(3): 825-838, doi: 10.1007/s00216-015-9169-1.
10. Nalesso A., Viel G., Cecchetto G., Frison G., Ferrara S.D. Analysis of the alcohol biomarker phosphatidylethanol by NACE with on-line ESI-MS. Electrophoresis 2010; 31(7):1227-1233, doi: 10.1002/elps.200900430
11. Oppolzer D., Barroso M., Gallardo E. Bioanalytical procedures and developments in the determination of alcohol biomarkers in biological specimens. Bioanalysis 2016; 8(3): 229-251, doi: 10.4155/bio.15.240
12. Luginbühl M., Stöth F., Schröck A., Gaugler S., Weinmann W. Quantitative determination of phosphatidylethanol in dried blood spots for monitoring alcohol abstinence. Nature Protocols 2021; 16(1): 283-308, doi: 10.1038/s41596-020-00416
13. Zhang X., Zheng F., Lin Z., Johansen S., Yu T., Liu Y., Huang Z., Li J., Yan J., Rao Y. Simultaneous determination of ethanol's four types of non‐oxidative metabolites in human whole blood by liquid chromatography tandem mass spectrometry. Analytica Chimica Acta 2017; 963:68‐75, doi: 10.1016/j.aca.2017.01.040
14. Duarte M., Jagadeesan K.K., Billing J., Yilmaz E., Laurell T., Ekstrom S. Solid‐phase extraction of the alcohol abuse biomarker phosphatidylethanol using newly synthesized polymeric sorbent materials containing quaternary heterocyclic groups. Journal of Chromatography A 2017; 1519: 1‐8, doi: 10.1016/j.chroma.2017.08.051
15. Berg T., Eliassen E., Jorgenrud B., Kabashi S., Petukhov A.E., Bogstrand S.T. Determination of phosphatidylethanol 16:0/18:1 in whole blood by 96‐well supported liquid extraction and UHPLC‐MS/MS. Journal of Clinical Laboratory Analysis 2019; 33, doi: 10.1002/jcla.22631.
16. White D., O'Halloran S.J., Salman S.M., Macquillan G., Joyce D.A. Validation of a liquid chromatography tandem mass spectrometry (LC-MS/MS) method for erythrocyte phosphatidylethanol revealing critical considerations for its use as a clinical biomarker. Journal of chromatography B, Analytical technologies in the biomedical and life sciences 2022; 1192: 123134. doi: 10.1016/j.jchromb.2022.123134
17. Food and Drug Administration, Guidance for Industry: Bioanalytical Method Validation, U.S. Dep Heal. Hum. Serv. 2018, P. 4-10. Available at: https://www.fda.gov/files/drugs/published/Bioanalytical-Method-Validation-Guidance-for-Industry.pdf Accessed: 11.10.2022.