Авторы
Ирискулов Б. У.
д.м.н., профессор, заведующий, кафедра нормальной и патологической физиологии1
Абилов П. М.
свободный соискатель степени PhD, ассистент, кафедра нормальной и патологической физиологии1
1Ташкентская медицинская академия, г. Ташкент, Республика Узбекистан
Автор для корреспонденции
Абилов Пулат Мэлисович; e-mail: pulatabilov1985@mail.ru
Финансирование
Исследование не имело спонсорской поддержки.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Аннотация
В статье приводятся данные по такому известному грибу как Ganoderma lucidum. Отмечается, что после воздействия оксидативного стресса нормализуются физиологические показатели, отмечается восстановление супероксиданион-радикала, глутатиона, что доказано гистологическими, электронно-микроскопическими и биохимическими методами исследования. Обсуждены результаты, сделаны соответствующие выводы.
Ключевые слова
супероксиданион-радикал, глутатион, Ganoderma lucidum
Для цитирования
Ирискулов Б. У., Абилов П. М. Прогностическая значимость применения Ganoderma lucidum в условиях оксидативного стресса. Медицина 2020; 8(3): 96-111.
DOI
Актуальность
Как известно, в основе многих патологических процессов лежит перекисное окисление липидов (ПОЛ). ПОЛ вначале может вызываться гипоксия-индуцибельным фактором 1α (HIF-1α), который продуцируется клетками при кислородном голодании и активирует сосудистый эндотелиальный фактор роста, увеличивающий сосудистую проницаемость вместе с гистамином, брадикином, лейкотриенами [1]. В то же время важное место в возникновении окислительного стресса придается молекулам межклеточной адгезии iCAM-1, который по сути является лигандом интегрина и представляет собой сиалированный олигосахарид. Начальные роллинговые взаимодействия начинаются с селектинов. Например, VCAM-1, который, по сути, представляет молекулу адгезии сосудистого эндотелия для E-селектина и его интегрина VLA-4. Сначала селектины не активны, то есть обладают низкой аффинностью, но, после того как к ним прикрепляются хемокины, они становятся высокоаффинными [2,3]. Однако, при окислительном стрессе видоизмененные Toll-рецепторы не могут самостоятельно распознавать микробные агенты за счет измененной химической формулы L-глюкозозамина и таким образом активации медиаторов не происходит. В настоящее время ведутся научные споры по поводу HMGB1 белка, так как в недавних исследованиях было показано, что данный белок регулирует деятельность Toll-подобных рецепторов через сигнальные пути и по принципу обратной связи активирует и видоизменяет Toll-рецепторы [4,5]. Но, чтобы HMGB 1 белок выделился, необходимы условия, при которых данный белок связывается через лиганды к Toll-подобным рецепторам. Этих лиганд при гипоксии не бывает. В то же время тритерпены, благодаря своей уникальной последовательности, могут образовывать путь для образования лиганд к Toll-подобным рецепторам, вызывать их активацию и даже видоизменять их. Существует очень много работ по тритерпенам, однако их роль в возникновении окислительно-восстановительной реакции до конца не ясна. Так, одним из известных натуральных (природных) источников тритерпенов является Ganoderma lucidum.
Известно, что Ganoderma lucidum содержит тритерпены и полиглюканы. Во многих работах [6] было показано, что Ganoderma lucidum активирует лейкоциты через воздействие на Sialil-Lewis X модифицированный гликопротеин, вызывая стойкую адгезию к эндотелию через селектины (Е-селектин) [7-10]. Известно, что Ganoderma lucidum увеличивает экспрессию TNF и IL-1, в то же время эти цитокины индуцируют экспрессию эндотелиальными клетками лигандов к интегринам для VCAM 1 и ICAM 1. Как известно, такая комбинация цитокин-индуцированной экспрессии лигандов интегринов на эндотелии и активация лейкоцитарных интегринов приводит к плотному интегрин-опосредованному сцеплению лейкоцитов с эндотелием в очаге воспаления [11-15]. В то же время интегрины LFA 1 и Mac 1 могут в малой степени содержать фукозосодержащий лиганд Sialyl-Lewis Х гликопротеин и поэтому миграции лейкоцитов в должной степени не происходит. Так, Ganoderma lucidum за счет β-поликлюканов, которые по химической формуле близки к данному гликопротеину может взаимодействовать с рецепторами лейкоцитов и увеличивать молекулы адгезии и миграцию лейкоцитов [16-20]. В то же время при окислительном стрессе IL-8 и С5а комплемент не связываются со специфическими 7-трансмембранными G-белок связанными рецепторами на поверхности лейкоцитов. Ganoderma lucidum, являясь промежуточным элементом между данными цитокинами и рецептором, встраивается своими аминокислотными остатками в цепочку цитокина IL-8, улучшает его восприимчивость и активность и помогает встраиваться в данный рецептор. В то же время в состав комплемента С5а он входит благодаря тритерпенам, увеличивающим узнаваемость данного комплемента 7-трансмембранными G-белок связанными рецепторами [21-29].
В настоящее время не до конца изучено действие Ganoderma lucidum на физиологическое состояние организма, а также возможность использования для коррекции изменений свободнорадикальных процессов, что и определило актуальность проводимого исследования.
Цель исследования
Цель исследования – оценить прогностическую значимость воздействия Ganoderma lucidum на состояние оксидативного стресса.
Материалы и методы исследования
Для осуществления поставленной цели были исследованы белые беспородные мыши обоего пола в количестве 100 шт. массой 15-20 гр. Эксперимент длился 30 суток и проходил с соблюдением правил, предусмотренных Европейской комиссией по надзору за проведением лабораторных и других опытов с участием экспериментальных животных разных видов. Все мыши находились в стандартных условиях с естественной сменой освещения и соблюдением общевиварийного рациона. У всех животных был свободный доступ к пище и воде. Были соблюдены все биоэтические принципы работы с лабораторными животными.
Материалы исследования
Все экспериментальные животные были разделены на 4 группы:
1 группа – 10 мышей – контрольная, абсолютно здоровые мыши.
2 группа – 1 основная группа (20 мышей), у которых острую печеночную недостаточность вызывали путем однократного внутрибрюшинного введения 50% ССl4 0,06 мл масляного раствора (оливковое масло) – из расчета 0,3 мл на 100 гр. тела.
3 группа – 2 основная (20 мышей), у которых острую печеночную недостаточность вызывали путем однократного внутрибрюшинного введения 50% ССl4 0,06 мл масляного раствора (оливковое масло) – из расчета 0,3 мл на 100 гр. тела, но коррекцию обменных нарушений проводили интактным препаратом (5%-2,0 ml аскорбиновой кислоты).
4 группа – 3 основная (40 мышей), у которых острую печеночную недостаточность вызывали путем однократного внутрибрюшинного введения 50% ССl4 0,06 мл масляного раствора (оливковое масло) – из расчета 0,3 мл на 100 гр. тела, но коррекцию обменных нарушений проводили биологически активными веществами на основе Ganoderma lucidum (в дозировке 100 мг/кг массы тела).
Эвтаназию животных проводили под эфирным наркозом, после чего декапитировали на 3, 10, 20 и 30 сутки и определяли в сыворотке крови биохимические показатели перекисного окисления липидов и активность ферментов антиоксидантной защиты.
В работе использовали электронный микроскоп FE-TEM HF 5000 фирмы Hitachi HT. Разрешение составляет 0,1 нм.
Методы исследования
1. Определение активности ферментов дыхательной цепи митохондрий путем измерения активности цитохрома С, А3, окислительного фосфорилирования и сопряженности оксидативного стресса на фоне введения Ganoderma lucidum.
2. Определение активности свободных радикалов путем определения диеновых, триеновых конъюгантов на фоне введения Ganoderma lucidum.
3. Определение архитектоники структурных форм гепатоцитов на фоне введения Ganoderma lucidum.
4. Статистические (критерий Манна-Уинни, Вилкоксона).
Измерение активности ферментов дыхательной цепи митохондрий путем измерения активности цитохрома С определяли спектрофотометрическим методом, который основан на измерении оптической плотности раствора восстановленного цитохрома С, имеющего максимум поглощения 550 нм (восстановление цитохрома С сопровождается изменением цвета раствора от красновато-оранжевого до ярко-розового). Показателем активности служит величина падения оптической плотности раствора за определенный промежуток времени. Измерение активности цитохрома А3 определяли аналогичным образом, так как цитохром А3 катализирует окисление цитохрома С. Определение окислительного фосфорилирования и сопряженности оксидативного стресса проводили по методу Чанса-Вильямса, основанному на том, что в отсутствие АТФ фосфорилирование не идет. Окисление в то же время имеет определенную величину. При добавлении АТФ в инкубационную среду начинает идти фосфорилирование и происходит стимулирование окислительной активности митохондрий.
Определение активности свободных радикалов путем определения диеновых, триеновых конъюгантов основано на принципе перегруппировки двойных связей и возникновении системы сопряженных диеновых структур, имеющих максимум поглощения при 232-234 нм с плечом в области 260-280 нм, соответствующим сопряженным кетодиенам.
Определение цитоархитектоники гепатоцитов проводили по стандартной методике. Кусочки печени мышей фиксировали в 10% нейтральном формалине, заливали в парафиновые блоки, из которых с помощью микротома приготавливали срезы толщиной 5 мкм. Срезы окрашивали гематоксилин-эозином.
Исследование проводили сразу после лечения, через 3, 7, 10 и 30 суток.
Результаты исследования
Результаты гистологических исследований
В процессе исследования изучаемые группы не имели статитистически значимых различий по весу (U-критерий Манна-Уитни – 3,074, р≤0,001).
Токсическое поражение печени воздействием ССl4 приводит к появлению в печени мышей признаков воспаления, жирового перерождения, фиброза. Дальнейшее воздействие тетрахлористым углеродом приводит к появлению соединительной ткани. В 1, 2 основных группах гепатоциты по ходу соединительнотканных тяжей вакуолизированы и содержат большое количество липидных капель (рис. 1).
Рис.1. Признаки воспаления в гепатоцитах после воздействия ССl4. Вид под электронным микроскопом (увеличение х 10000000). А – на 1 сутки эксперимента. В – на 14 сутки эксперимента.
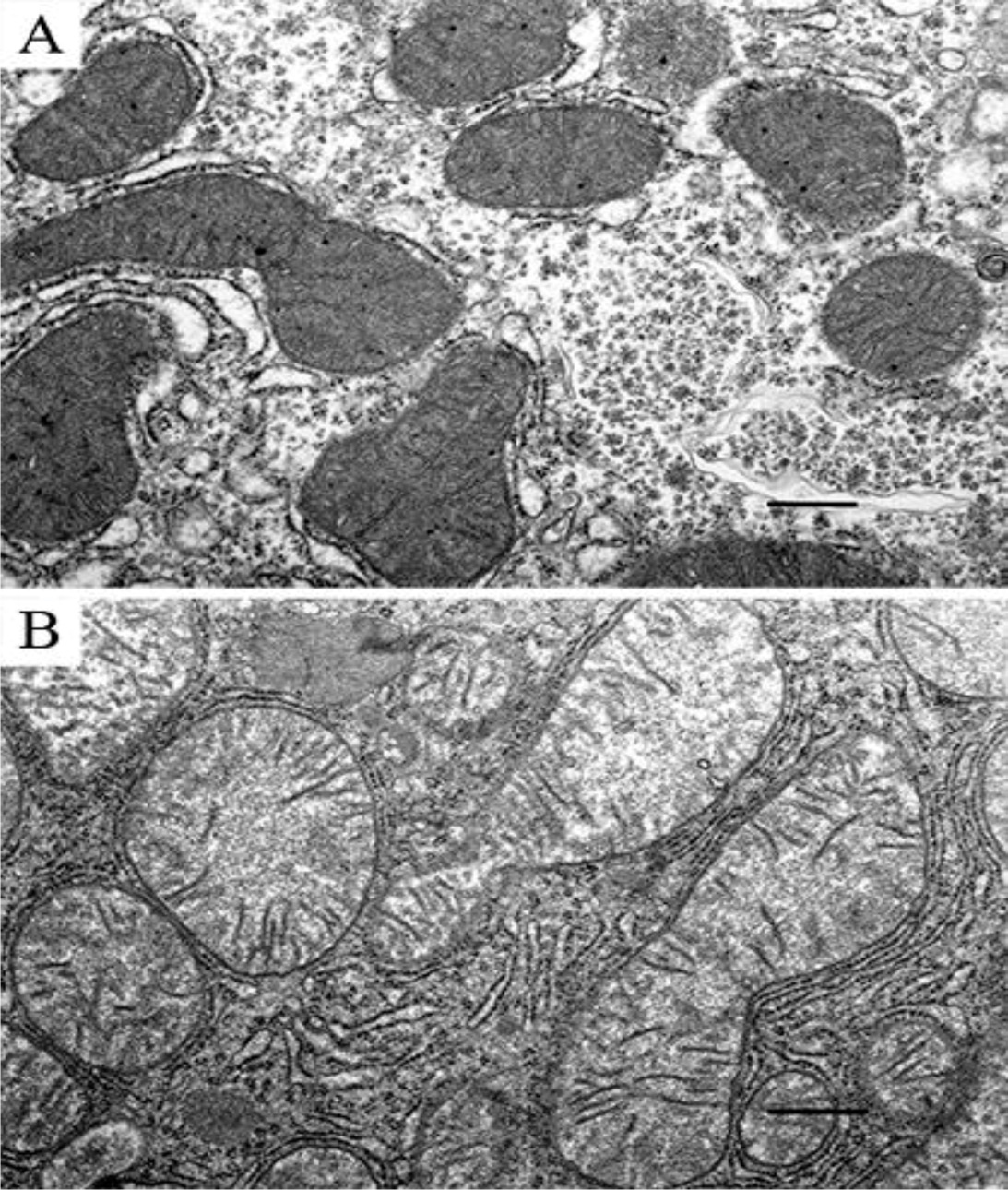
Рис.2. Pit-клетка после воздействия Ganoderma lucidum на 14 сутки эксперимента. Вид под электронным микроскопом (увеличение х 1000000).

Рис. 3. Митохондрии после воздействия Ganoderma lucidum на 14 сутки эксперимента. Вид под электронным микроскопом (увеличение х 10000000).

Рис. 4. Митохондрии после воздействия Ganoderma lucidum на 14 сутки эксперимента. Вид под электронным микроскопом (увеличение х 10000000).

Стенки сосудов утолщены и фиброзированы. В паренхиме печени, особенно вблизи сосудов видны активированные клетки Купфера и лейкоцитарные инфильтраты. В 1 и 2 основных группах паренхима печени регенерирует очень слабо, что связано с практически полным отсутствием митозов в гепатоцитах.
В 3 основной группе паренхима печени активно регенерирует, свидетельством чего являются часто встречающиеся митозы гепатоцитов, в то же время именно в этой группе, где мыши получали Ganoderma lucidum жировая дистрофия была выражена значительно слабее, также влияние Ganoderma lucidum было оценено по способности биологически активных веществ увеличивать степень фиброзирования процессов и уменьшать воспалительные процессы.
Изолированные гепатоциты в контрольной группе (нормальные мыши) имели правильную округлую форму с центрально расположенным ядром, четко очерченную плазматическую мембрану, большое количество цитоплазмы. В 1 и 2 основных группах гепатоциты были значительно разнообразнее по размерам, встречались очень крупные клетки с большими полиплоидными ядрами. В цитоплазме часто присутствовали вакуоли, плазматическая мембрана имела много выпячиваний. В 3 основной группе после воздействия Ganoderma lucidum доля неповрежденных гепатоцитов составила 68±2,0 % (р≤0,05) по сравнению с 2 и 3 основных группах (32,0±3,5%, р≤0,05).
Результаты биохимических исследований
Гепатиты токсической природы получают все большее распространение в мире, что определяет большой интерес исследователей к данной проблеме [1]. По общему мнению исследователей, ключевым звеном патологического процесса является нарушение работы дыхательной цепи митохондрий гепатоцитов, в основе которого лежит усиление продукции АФК – окислительный стресс [6,8,32]. Вместе с тем литературные данные, посвященные исследованию состояния дыхательной цепи митохондрий при токсическом гепатите, неполны и весьма противоречивы.
Проведенное исследование показало, что активность цитохрома С в 2 и 3 основных группах было значительно выше, чем в 1 основной группе. В частности, это связано с влиянием тритерпеновых фракций и β-δ-полигюканов повышающим цитохромоксидазу печени за счет повышения неспецифической резистентности организма в результате чего оптическая плотность раствора падает. Причем в 3 основной группе активность цитохромоксидазы была выше на 37,8% (р≤0,05), чем в 1 и 2 основных группах и составляла 59,0±1,05 нмоль сукцината/мг белка в мин. (при норме 61,09±1,09 нмоль сукцината/мг белка в мин). В 1 и 2 основных группах активность цитохрома с была понижена на 38% (р≤0,01) и 44% (р≤0,01) соответственно. В результате, после повышения активности цитохрома С ускорились эндогенные окислительно-восстановительные реакции и обменные процессы в тканях, улучшилась утилизация кислорода и снизилась гипоксия в тканях при отравлении ССl4.
Как известно, механизм оксилительного фосфорилирования и сопряженности оксидативного стресса заключается в том, что перенос каждой пары электронов от NADН на кислород сопровождается транслокацией 6 протонов с внутренней на наружную сторону митохондриальной мембраны.
В проведенном исследовании было установлено, что в 1 и 2 группах не создавалось замкнутой мембранной системы. В результате отравления тетрахлористым углеродом АТФ в митохондриях не может образоваться в результате нарушения компонентов дыхательной цепи, причем активность ферментов, находящиеся на внутренней мембране митохондрий была ниже на 45±2,0% (р≤0,05), так как фосфорилирующие субъединицы и их белки не образовывали АТФ-синтазу. Это скорее всего связано с отсутствием так называемого стебелька, который связывает фосфорилирующие субъединицы с мембранной белковой субъединицей и при этом не образуется молекула АТФ. Причем в 1 и 2 группах, по-видимому, протоны не атакуют атомы кислорода, в результате чего не образуется АТФ.
В 3 группе после приема Ganoderma lucidum, за счет входящего в ее состав органического германия, добавляются новые протоны, которые атакуют атомы кислорода, в результате чего образуется АТФ. Причем Ganoderma lucidum приводит к образованию замкнутой мембранной системы, в результате чего функционирует векторная АТФ-синтаза и компоненты дыхательной цепи уложены в мембране упорядоченно. В частности, F1 субъединица активируется в результате трех петель дыхательной цепи.
В 1 и 2 основных группах содержание АТФ было снижено на 45±3,0% (р≤0,01) и 56±2,5% (р≤0,01) соответственно. В 3 основной группе после приема Ganoderma lucidum и на 3, 7, 10 и 30 сутки происходило достоверное увеличение содержания АТФ на 34,0±2,0%, 42,5±2,0%, 57,0±3,0% и 67±2,5% (р≤0,05) соответственно (рис. 5, 6).
После лечения Ganoderma lucidum видно, что происходит повышение активности всей дыхательной цепи (цитохрома С, А, окислительного фосфорилирования и сопряженности оксидативного стресса).
Принцип метода определения диеновых конъюгантов основывается на установлении содержания первичных продуктов ПОЛ в крови по поглощению липидным экстрактом монохроматичного светового потока в ультрафиолетовой области спектра, так как молекулы с двумя сопряженными связями (диеновые конъюганты) обладают максимумом поглощения при 233 нм.
Рис 5. Динамика показания окислительного фосфорилирования и сопряженности оксидативного стресса до лечения.

Рис. 6. Динамика показания окислительного фосфорилирования и сопряженности оксидативного стресса после лечения.

При этом, в 1 и 2 основных группах определенное содержание диеновых конъюгантов колебалась на уровне 0,400 ед. опт. пл/мг липидов (р≤0,001), а в 3 группе после лечения Ganoderma lucidum этот показатель составил 0,300 ед. опт. пл/мг липидов (р≤0,001).
Постепенное снижение диеновых и триеновых конъюгантов свидетельствует об успешном лечении и благоприятном прогнозе (рис. 7,8).
Согласно критерию Вилкоксона наибольший перцентиль Q1=132, а наименьший Q4=78, что соответствует р≤0,05. Критерии Манна-Уитни и Вилкоксона использовались, так как нами оценивалась разность между медианами двух генеральных совокупностей.
Рис. 7. Показатели диеновых и триеновых конъюгантов до лечения, после лечения, а также через 30 суток после лечения.

Рис. 8. Динамика содержания диеновых и триеновых конъюгантов до лечения, после лечения, а также через 30 суток после лечения.

Выводы
1. Изучение цитоархитектоники гепатоцитов выявило, что после воздействия токсического яда, такого как тетрахлористый углерод на фоне применения Ganoderma lucidum происходила активная регенерация паренхимы печени, жировая дистрофия была выражена значительно слабее, чем в 1 и 2 основных группах.
2. Активность цитохромов С, А после воздействия Ganoderma lucidum была значительно выше, что связано с действием тритерпеновых фракций и β-δ- полиглюканов, повышающих цитохромоксидазу печени за счет повышения неспецифической резистентности организма.
3. Постепенное снижение диеновых и триеновых конъюгантов на фоне применения Ganoderma lucidum свидетельствует об успешном лечении и благоприятном прогнозе.
4. Представленные результаты лечения оксидативного стресса биологически активными веществами на основе Ganoderma lucidum позволяют использовать их и в клинической практике.
Список литературы
1. Устинова, А. А., Рябинин, В. Е. Процессы перекисного окисления липидов в селезенке при хроническом действии ионизирующего излучения. Биомедицинская химия 2003; 49(3): 263-266.
2. Iriskulov B.U., Saydalikhodjaeva O.Z., Abilov P.M., Seytkarimova G.S., Norboeva S.A., Musaev Kh.A. An experimental assessment of the influence of Ganoderma lucidum on the state of oxidative stress. International journal of scientific & technology research 2020; 9(3): 6645-6649.
3. Abilov P.M., Iriskulov B.U. Application of new target therapy at viral pandemia of the XXI century COVID-19 Sci-article 2020; (80): 211-221.
4. Umarova Z.F. Assessment of the Dynamics of Indicators of Unstable Atherosclerotic Plaque in Ct-Coronary Angiography with the Use of Ganoderma Lucidum. International journal of scientific & technology research 2020; 9(3): 4345-4348.
5. Lu S.-Y., Peng X.-R., Dong J.-R., et at. Aromatic constituents from Ganoderma lucidum and their neuroprotective and anti-inflammatory activities. Fitoterapia 2019; 134: 58-64. doi: 10.1016/j.fitote.2019.01.013
6. Avasarala S., Bikkavilli R.K., Van Scoyk M., Zhang W., Lapite A., Hostetter L., et al. (2013. a). Heterotrimeric G-protein, Galpha16, is a Critical Downstream Effector of Non-Canonical Wnt signaling and a Potent Inhibitor of Transformed Cell Growth in Non Small Cell Lung Cancer. PloS One 2013; 8(10): e76895. doi: 10.1371/journal.pone.0076895
7. Sharma С., et at. Bioactive metabolites of Ganoderma lucidum: Factors, mechanism and broad spectrum therapeutic potential. Journal of Herbal Medicine 2019; 17-18: 100268. doi: 10.1016/j.hermed.2019.100268
8. Cederbaum A.I. Role of Cytochrome P450 and Oxidative Stress in Alcohol-Induced Liver Injury. Reactive Oxygen Species 2017; 4(11): 303-319.
9. Xu. Y., Zhang X., Yan X.-H., et at. Characterization, hypolipidemic and antioxidant activities of degraded polysaccharides from Ganoderma lucidum. International Journal of Biological Macromolecules, 2019; 135: 706-716. doi: 10.1016/j.ijbiomac.2019.05.166
10. Abilov P.M., Makhkamova F.T. Clinical and functional evaluation of the effectiveness of treatment of chronic catarrhal gingivitis in children with the use of biologically active additives based on Ganoderma lucidum. Pediatric, Scientific and practical journal 2018; (1): 108-111.
11. Kang Q., Chen S., Li S., et al. Comparison on characterization and antioxidant activity of polysaccharides from Ganoderma lucidum by ultrasound and conventional extraction. International Journal of Biological Macromolecules 2019; 124: 1137-1144. doi: 10.1016/j.ijbiomac.2018.11.215
12. Luo K., Yang Z.-L. Cheng Y.-X. Dayaolingzhiols A-E, AchE inhibitory meroterpenoids from Ganoderma lucidum. Tetrahedron 2019; 75: 2910-2915. doi: 10.1016/j.tet.2019.04.022
13. Zhu L.-F., Yao Y., Ahmad Z., Chang M.-W. Development of Ganoderma lucidum spore powder based proteoglycan and its application in hyperglycemic, antitumor and antioxidant function. Process Biochemistry 2019; 84: 103-111. doi: 10.1016/j.procbio.2019.05.025
14. Gurovic M.S.V., Viceconte F.R., Pereyra M.T. DNA damaging potential of Ganoderma lucidum extracts. Journal of Ethnopharmacology 2018; 217; 83-88. doi: 10.1016/j.jep.2018.02.005
15. Abilov P.M. Efficiency of individual prophylaxis of dental caries using dental gel Ispring based on Ganoderma lucidum in schoolchildren in Tashkent. Journal of Dental and Oral Health 2018; (5): 1-4.
16. Zeng H., Li P., Chen X., et al. Effects of deproteinization methods on primary structure and antioxidant activity of Ganoderma lucidum polysaccharides. International journal of Biological Macromolecules 2019; 126: 867-876. doi: 10.1016/j/ijbiomac.2018.12.222
17. Shao P., Xuan S., Wu W., Qu l. Encapsulation efficiency and controlled release of Ganoderma lucidum polysaccharide microcapsules by spray drying using different combinations of wall materials. International Journal of Biological Macromolecules 2019; 125: 962-969. doi: 10.1016/j.ijbiomac.2018.12.153
18. Zhu L.-F., Chen X., Ahmad Z., et al. Engineering of Ganoderma lucidum polysaccharide loaded polyvinyl alcohol nanofibers for biopharmaceutical delivery. Journal of Drug Delivery Science and Technology 2019; 50: 208-216. doi: 10.1016/j.jddst.2019.01.032
19. Murata C., Tran Q.T., Onda S., Usuki T. Extraction and isolation of ganoderic acid Σ from Ganoderma lucidum. Tetrahedron Letters 2016; 57(48): 5268-5371. doi: 10.1016/j.tetlet.2016.10.072
20. Liu Y., Zhang W., Sun M., Zhang Z. Hypoglycemic effect of inulin combined with ganoderma lucidum polysaccharides in T2DM rats. Journal of Functional Foods 2019; 55: 381-390. doi: 10.1016/j.jff.2019.02.036
21. Wu S. Hypolipidaemic and anti-lipidperoxidant activities of Ganoderma lucidum polysaccharide. International Journal of Biological Macromolecules 2018. doi: 10.1016/j.ijbiomac.2018.07.082
22. Umarova Z.F. Improving the Methods of Diagnosis and Treatment of Patients with Chronic Kidney Disease. International journal of scientific & technology research 2020; 9(6): 731-736.
23. Zhou D., Zhou F., Ma J., Ge F. Microcapsulation of Ganoderma Lucidum spores oil: Evaluation of its fatty acids composition and enhancement of oxidative stability. Industrial Crops & Products 2019; 131: 1-7. doi: 10.1016/j.indcrop.2019.01.031
24. Abilov P.M. Perfection of methods of diagnostics and treatment of acute herpetic stomatitis in children. Sci-article 2017; (10): 18-25.
25. Lv X.-C., Guo W.-L., Li L., et al. Polysaccharide peptides from Ganoderma lucidum ameliorate lipid metabolic disorders and gut microbiota dysbiosis in high-fat diet-fed rats. Journal of Functional Foods 2019; 57: 48-58. doi: 10.1016/j.jff.2019.03.043
26. Gu L., Zheng Y., Lian D., et al. Production of triterpenoids from Ganoderma lucidum: Elicitation strategy and signal transduction. Process Biochemistry 2018; 69: 22-32. doi: 10.106/j.procbio.2018.03.019
27. Jin M., Zhang H., Wang J., et al. Response of intestinal metabolome to polysaccharides from mycelia of Ganoderma lucidum. International Journal of Biological Macromolecules 2019; 122: 723-731. doi: 10.1016/j.ijbiomac.2018.10.224
28. Liang C., Tian D., Liu Y., et al. Review of the molecular mechanisms of Ganoderma lucidum triterpenoids: Ganoderic acids A, C2, D, F, DM, X and Y. European Journal of Medicinal Chemistry 2019; 174: 130-141. doi: 10.1016/j.ejmech.2019.04.039
29. Ren A., Shi L., Zhu J., et al. Shedding light on the mechanisms underlying the environmental regulation of secondary metabolite ganoderic acid in Ganoderma lucidum using physiological and genetic methods. Fungal Genetics and Biology 2019; 128: 43-48. doi: 10.1016/j.fgb.2019.03.009
30. Chuong V.T., Chen W., Shi J., et al. The anti-oxidation and anti-aging effects of Ganoderma lucidum in Caenorhabditis elegans. Experimental Gerontology 2019; 117: 99-105. doi: 10.1016/j.exger.2018.11.016
31. Sargowo D. The role of polysaccharide peptide of Ganoderma Lucidum as a potent antioxidant against atherosclerosis in high risk and stable angina patients. Indian Heart J. 2018; 70 (5): 608-614.
32. Zhang Z., Diao H., Wang H., et al. Use of Ganoderma Lucidum polysaccharide to control cotton fusarium wilt, and the mechanism involved. Pesticide Biochemistry and Physiology 2019; 158: 149-155. doi: 10.1016/j.pestbp.2019.05.003
33. Wang Z.X., Qiao X.Y., Hao S.N., Ji R. Demonstration of hepatoprotective action of camel milk through improving antioxidant activity and regulating gene expression in mice. J. Camel Pract. Res. 2017; 24(2): 169. doi: 10.5958/2277-8934.2017.00026.1
Prognostic Value of the Use of Ganoderma Lucidum Under Conditions of Oxidative Stress
Authors
Irsikulov B. U.
Doctor of Medicine, Professor, Head, Chair for Normal and Pathological Physiology1
Abilov P. M.
PhD candidate, Assistant, Chair for Normal and Pathological Physiology1
1 - Tashkent Medical Academy, Tashkent, Republic of Uzbekistan
Corresponding Author
Pulat Abilov; e-mail: pulatabilov1985@mail.ru
Conflict of interest
Authors have no conflict of interest.
Funding
The study had no sponsorship.
Abstract
The article provides data on such a well-known fungus as Ganoderma lucidum. It is noted that after exposure to oxidative stress, physiological parameters are normalized, the superoxidation radical, glutathione is restored, which is proven by histological, electron microscopic and biochemical research methods. The results are discussed, and the corresponding conclusions are drawn.
Key words
superoxide radical anion, glutathione, Ganoderma lucidum
DOI
References
1. Ustinova A.A., Ryabinin V.E. Processy perekisnogo okisleniya lipidov v selezenke pri hronicheskom dejstvii ioniziruyushchego izlucheniya. Biomedicinskaya himiya [Biomedical Chemistry] 2003; 49(3): 263-266.
2. Iriskulov B.U., Saydalikhodjaeva O.Z., Abilov P.M., Seytkarimova G.S., Norboeva S.A., Musaev Kh.A. An experimental assessment of the influence of Ganoderma lucidum on the state of oxidative stress. International journal of scientific & technology research 2020; 9(3): 6645-6649.
3. Abilov P.M., Iriskulov B.U. Application of new target therapy at viral pandemia of the XXI century COVID-19 Sci-article 2020; (80): 211-221.
4. Umarova Z.F. Assessment of the Dynamics of Indicators of Unstable Atherosclerotic Plaque in Ct-Coronary Angiography with the Use of Ganoderma Lucidum. International journal of scientific & technology research 2020; 9(3): 4345-4348.
5. Lu S.-Y., Peng X.-R., Dong J.-R., et at. Aromatic constituents from Ganoderma lucidum and their neuroprotective and anti-inflammatory activities. Fitoterapia 2019; 134: 58-64. doi: 10.1016/j.fitote.2019.01.013
6. Avasarala S., Bikkavilli R.K., Van Scoyk M., Zhang W., Lapite A., Hostetter L., et al. (2013. a). Heterotrimeric G-protein, Galpha16, is a Critical Downstream Effector of Non-Canonical Wnt signaling and a Potent Inhibitor of Transformed Cell Growth in Non Small Cell Lung Cancer. PloS One 2013; 8(10): e76895. doi: 10.1371/journal.pone.0076895
7. Sharma С., et at. Bioactive metabolites of Ganoderma lucidum: Factors, mechanism and broad spectrum therapeutic potential. Journal of Herbal Medicine 2019; 17-18: 100268. doi: 10.1016/j.hermed.2019.100268
8. Cederbaum A.I. Role of Cytochrome P450 and Oxidative Stress in Alcohol-Induced Liver Injury. Reactive Oxygen Species 2017; 4(11): 303-319.
9. Xu. Y., Zhang X., Yan X.-H., et at. Characterization, hypolipidemic and antioxidant activities of degraded polysaccharides from Ganoderma lucidum. International Journal of Biological Macromolecules, 2019; 135: 706-716. doi: 10.1016/j.ijbiomac.2019.05.166
10. Abilov P.M., Makhkamova F.T. Clinical and functional evaluation of the effectiveness of treatment of chronic catarrhal gingivitis in children with the use of biologically active additives based on Ganoderma lucidum. Pediatric, Scientific and practical journal 2018; (1): 108-111.
11. Kang Q., Chen S., Li S., et al. Comparison on characterization and antioxidant activity of polysaccharides from Ganoderma lucidum by ultrasound and conventional extraction. International Journal of Biological Macromolecules 2019; 124: 1137-1144. doi: 10.1016/j.ijbiomac.2018.11.215
12. Luo K., Yang Z.-L. Cheng Y.-X. Dayaolingzhiols A-E, AchE inhibitory meroterpenoids from Ganoderma lucidum. Tetrahedron 2019; 75: 2910-2915. doi: 10.1016/j.tet.2019.04.022
13. Zhu L.-F., Yao Y., Ahmad Z., Chang M.-W. Development of Ganoderma lucidum spore powder based proteoglycan and its application in hyperglycemic, antitumor and antioxidant function. Process Biochemistry 2019; 84: 103-111. doi: 10.1016/j.procbio.2019.05.025
14. Gurovic M.S.V., Viceconte F.R., Pereyra M.T. DNA damaging potential of Ganoderma lucidum extracts. Journal of Ethnopharmacology 2018; 217; 83-88. doi: 10.1016/j.jep.2018.02.005
15. Abilov P.M. Efficiency of individual prophylaxis of dental caries using dental gel Ispring based on Ganoderma lucidum in schoolchildren in Tashkent. Journal of Dental and Oral Health 2018; (5): 1-4.
16. Zeng H., Li P., Chen X., et al. Effects of deproteinization methods on primary structure and antioxidant activity of Ganoderma lucidum polysaccharides. International journal of Biological Macromolecules 2019; 126: 867-876. doi: 10.1016/j/ijbiomac.2018.12.222
17. Shao P., Xuan S., Wu W., Qu l. Encapsulation efficiency and controlled release of Ganoderma lucidum polysaccharide microcapsules by spray drying using different combinations of wall materials. International Journal of Biological Macromolecules 2019; 125: 962-969. doi: 10.1016/j.ijbiomac.2018.12.153
18. Zhu L.-F., Chen X., Ahmad Z., et al. Engineering of Ganoderma lucidum polysaccharide loaded polyvinyl alcohol nanofibers for biopharmaceutical delivery. Journal of Drug Delivery Science and Technology 2019; 50: 208-216. doi: 10.1016/j.jddst.2019.01.032
19. Murata C., Tran Q.T., Onda S., Usuki T. Extraction and isolation of ganoderic acid Σ from Ganoderma lucidum. Tetrahedron Letters 2016; 57(48): 5268-5371. doi: 10.1016/j.tetlet.2016.10.072
20. Liu Y., Zhang W., Sun M., Zhang Z. Hypoglycemic effect of inulin combined with ganoderma lucidum polysaccharides in T2DM rats. Journal of Functional Foods 2019; 55: 381-390. doi: 10.1016/j.jff.2019.02.036
21. Wu S. Hypolipidaemic and anti-lipidperoxidant activities of Ganoderma lucidum polysaccharide. International Journal of Biological Macromolecules 2018. doi: 10.1016/j.ijbiomac.2018.07.082
22. Umarova Z.F. Improving the Methods of Diagnosis and Treatment of Patients with Chronic Kidney Disease. International journal of scientific & technology research 2020; 9(6): 731-736.
23. Zhou D., Zhou F., Ma J., Ge F. Microcapsulation of Ganoderma Lucidum spores oil: Evaluation of its fatty acids composition and enhancement of oxidative stability. Industrial Crops & Products 2019; 131: 1-7. doi: 10.1016/j.indcrop.2019.01.031
24. Abilov P.M. Perfection of methods of diagnostics and treatment of acute herpetic stomatitis in children. Sci-article 2017; (10): 18-25.
25. Lv X.-C., Guo W.-L., Li L., et al. Polysaccharide peptides from Ganoderma lucidum ameliorate lipid metabolic disorders and gut microbiota dysbiosis in high-fat diet-fed rats. Journal of Functional Foods 2019; 57: 48-58. doi: 10.1016/j.jff.2019.03.043
26. Gu L., Zheng Y., Lian D., et al. Production of triterpenoids from Ganoderma lucidum: Elicitation strategy and signal transduction. Process Biochemistry 2018; 69: 22-32. doi: 10.106/j.procbio.2018.03.019
27. Jin M., Zhang H., Wang J., et al. Response of intestinal metabolome to polysaccharides from mycelia of Ganoderma lucidum. International Journal of Biological Macromolecules 2019; 122: 723-731. doi: 10.1016/j.ijbiomac.2018.10.224
28. Liang C., Tian D., Liu Y., et al. Review of the molecular mechanisms of Ganoderma lucidum triterpenoids: Ganoderic acids A, C2, D, F, DM, X and Y. European Journal of Medicinal Chemistry 2019; 174: 130-141. doi: 10.1016/j.ejmech.2019.04.039
29. Ren A., Shi L., Zhu J., et al. Shedding light on the mechanisms underlying the environmental regulation of secondary metabolite ganoderic acid in Ganoderma lucidum using physiological and genetic methods. Fungal Genetics and Biology 2019; 128: 43-48. doi: 10.1016/j.fgb.2019.03.009
30. Chuong V.T., Chen W., Shi J., et al. The anti-oxidation and anti-aging effects of Ganoderma lucidum in Caenorhabditis elegans. Experimental Gerontology 2019; 117: 99-105. doi: 10.1016/j.exger.2018.11.016
31. Sargowo D. The role of polysaccharide peptide of Ganoderma Lucidum as a potent antioxidant against atherosclerosis in high risk and stable angina patients. Indian Heart J. 2018; 70 (5): 608-614.
32. Zhang Z., Diao H., Wang H., et al. Use of Ganoderma Lucidum polysaccharide to control cotton fusarium wilt, and the mechanism involved. Pesticide Biochemistry and Physiology 2019; 158: 149-155. doi: 10.1016/j.pestbp.2019.05.003
33. Wang Z.X., Qiao X.Y., Hao S.N., Ji R. Demonstration of hepatoprotective action of camel milk through improving antioxidant activity and regulating gene expression in mice. J. Camel Pract. Res. 2017; 24(2): 169. doi: 10.5958/2277-8934.2017.00026.1