Авторы
Малыгин А. С.
аспирант, кафедра фармакологии и клинической фармакологии1
Яснецов В. В.
д.м.н., ведущий научный сотрудник, лаборатория экспериментальной и клинической фармакологии2
1ФГБОУ ВО Тверской государственный медицинский университет Минздрава России
2ФБУН Государственный научный центр Российской Федерации – Институт медико-биологических проблем Российской академии наук
Автор для корреспонденции
Малыгин Александр Сергеевич; e-mail: dr.a.s.m@yandex.ru
Финансирование
Исследование не имело спонсорской поддержки.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Аннотация
Проведен фармакофорный анализ структуры вальпразоламида – 1,3,4-тиадиазолиламидного производного вальпроевой кислоты. Показано, что новый вальпроат содержит замещенную амидную группу, гидрофобный и электронодонорный домены – фармакофоры, которые определяют его противоэпилептическую активность. Вальпроевая кислота имеет только гидрофобный фрагмент. Модификация вальпроевой кислоты путем введения в ее структуру дополнительного фармакофора – 1,3,4-тиадиазола приводит к снижению токсичности и повышению противоэпилептической активности.
Ключевые слова
фармакофорный анализ, вальпроевая кислота, 1,3,4-тиадиазол, противоэпилептическая активность
Для цитирования
Малыгин А. С., Яснецов В. В. Фармакофорный анализ структуры нового 1,3,4-тиадиазолиламидного производного вальпроевой кислоты. Медицина 2020; 8(3): 58-66.
DOI
Введение
Проведение фармакофорного анализа биологически активных веществ и моделирование новых молекул на основе фармакофоров является перспективным направлением в повышении эффективности лекарственных средств различных фармакологических групп, в том числе с противоэпилептической активностью. Актуальность разработки новых антиконвульсантов связана с высокой частотой фармакорезистентности [1] и недостаточной безопасностью имеющихся препаратов [2]. В настоящее время известны различные фармакофоры, которые участвуют в реализации противосудорожных свойств лекарственных средств. В исследовании [3] показано, что простейшим фармакофором, определяющим противоэпилептическую активность, является α-замещенная амидная группа. S.N. Pandeya [4] предложил фармакофорную модель, в которой для противоэпилептических средств значимыми являются следующие фармакофоры: электронодонорный домен, гидрофобный арильный или иной дистальный гидрофобный радикал, водородные связи. Фармакофорный подход был успешно использован для поиска соединений с противоэпилептическими свойствами [5].
Антиконвульсантом наиболее простого строения является вальпроевая кислота, которая представляет собой жирную кислоту с химической структурой – 2-пропилпентановая кислота. Преимуществом вальпроевой кислоты является ее эффективность при эпилепсии различных форм, а также широкий спектр фармакологической активности, в том числе противоопухолевое, обезболивающее, антиретровирусное, нейропротекторное действие и др. [6-7]. В связи с этим целесообразным представляется модификация химической структуры вальпроевой кислоты путем введения дополнительных фармакофоров.
Новым 1,3,4-тиадиазолиамидным производным вальпроевой кислоты является N-(5-этил-1,3,4-тиадиазол-2-ил)-2-пропилпентанамид, синтезированный в АО "ВНЦ БАВ" (Московская область, Старая Купавна) [8]. Экспериментально было показано наличие у нового вальпроата противоэпилептической активности [9-10] и низкой токсичности [11]. Для оценки полученных результатов и определения направлений дальнейшего поиска эффективных противоэпилептических средств целесообразным является проведение фармакофорного анализа структуры данного вальпроата.
Цель исследования
Цель исследования – провести сравнительный фармакофорный анализ структуры вальпроевой кислоты и ее нового 1,3,4-тиадиазолиамидного производного.
Материалы и методы исследования
В работе исследовали N-(5-этил-1,3,4-тиадиазол-2-ил)-2-пропилпeнтанaмид – новое 1,3,4-тиадиазолиламидное производное вальпроевой кислоты с лабораторным наименованием вальпразоламид. Химическую структуру нового вальпроата устанавливали спектроскопическими методами (ИК-, ЯМР-, масс-спектрометрии) [9]. ИК-спектр (ν/см-1) вальпразоламида: 3302, 3030 (NH), 2981, 2959, 2860 (СН), 1545 (NHCO). ЯМР-спектр: 1H-ЯМР (400 MГц, DMSO-d6) δ ppm: 0,97 (s, 3H, CH3), 1,33 (s, 2H, CH2), 1,41–1,50 (m, 4H), 2,65 (s, 2H, CH2), 10,63 (s, 1H, NH); 13C-ЯМР (400 MГц, DMSO-d6) δ ppm: 13,48, 13,66, 20,06, 24,70, 35,27, 43,22, 155,85, 156,5, 175,00. Масс-спектр (с использованием электроспрей ионизации – ESI): ESI+ – m/z 256,1 ([M + H]+); ESI– – m/z 254,0 ([M – H] –).
Оценку фармакологической активности и токсичности вальпразоламида проводили в экспериментах на аутбредных мышах SNK обоего пола массой 19-21 г. Содержание подопытных животных и обращение с ними во время экспериментов соответствовали всем установленным требованиям [12-13]. В качестве референтного препарата применяли вальпроевую кислоту. Значение LD50 (полулетальной дозы) вальпразоламида и вальпроевой кислоты определяли методом пробит-анализа. Нейротоксичность антиконвульсантов оценивали в тесте вращающегося стержня (rotarod test) [14]. Моделирование эпилепсии осуществляли с использованием отечественных [14] и зарубежных [15] рекомендаций. Оценку противоэпилептической активности проводили на моделях максимального электрошока, антагонизма с пентилентетразолом, изониазидом, тиосемикарбазидом, пилокарпином и камфорой. Определяли значения ЕD50 (средней терапевтической дозы), терапевтического (TI – отношение полулетальной дозы к средней терапевтической) и протективного (РI – отношение средней токсической дозы к средней терапевтической) индексов.
Для статистического анализа использовали "BioStat, 2009" (AnalystSoft; США). Для оценки типа распределения данных применяли W-критерий Шапиро-Уилка. При нормальном распределении данных использовали однофакторный дисперсионный анализ (ANOVA), при отсутствии нормального распределения – критерий Краскела-Уоллиса и U-тест Манна-Уитни. Расчет доз осуществляли методом пробит-анализа Финни с указанием 95% доверительного интервала.
Результаты исследования и их обсуждение
Вальпроевая (2-пропилпентановая) кислота – это короткоцепочечная насыщенная жирная кислота с разветвленной цепью, которая очень мало растворима в воде. Основным фармакофором, определяющим противоэпилептическую активность вальпроевой кислоты, является гидрофобный фрагмент, представляющий собой разветвленную углеводородную цепь (рис.1).
Рис. 1. Фармакофорный анализ структуры вальпроевой кислоты.
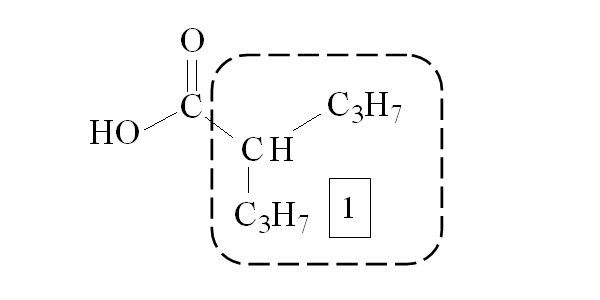
1 – гидрофобный фрагмент (разветвленный углеводородный радикал)
Вальпразоламид (N-(5-этил-1,3,4-тиадиазол-2-ил)-2-пропилпeнтанaмид) был получен путем модификации молекулы вальпроевой кислоты за счет введения дополнительных фармакофоров: замещенной амидной группы и электронодонорного домена (1,3,4-тиадиазола) (рис. 2).
Рис. 2. Фармакофорный анализ структуры вальпразоламида.
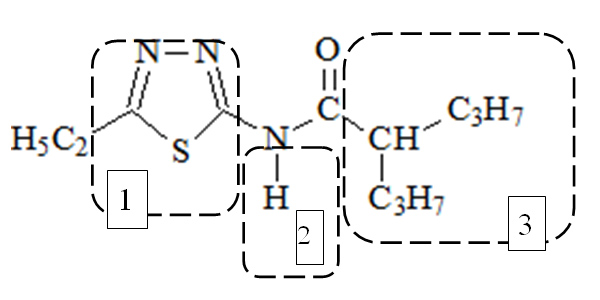
1 – электронодонорный домен; 2 – замещенная амидная группа; 3 – гидрофобный фрагмент
По результатам пробит-анализа величина полулетальной дозы (LD50) вальпразоламида при внутрибрюшинном введении мышам составила 924,8 (756,9 ÷ 1063,7) мг/кг, что было в среднем в 1,8 раза (р<0,05) выше, чем у вальпроевой кислоты – 512,9 (399,0÷611,7) мг/кг. Полученные данные свидетельствуют о меньшей острой токсичности модифицированного вальпроата.
Наличие противоэпилептической активности у вальпразоламида было показано в экспериментах на мышах при судорогах, индуцированных максимальным электрошоком (МЭШ) и в тестах антагонизма с конвульсантами, имеющими различные механизмы действия (табл. 1).
Таблица 1. Механизм действия конвульсантов и эффективность вальпразоламида при судорогах, индуцированных химическими агентами
| Конвульсант | Механизм действия конвульсанта | Эффективность вальпразоламида |
| Пентилентетразол (95 мг/кг, подкожно) | Антагонист ГАМКА-рецепторов | Уменьшение летальности Удлинение латентного периода судорог |
| Изониазид (250 мг/кг внутрибрюшинно) | Ингибитор синтеза ГАМК (ингибитор глутаматдекарбоксилазы) | Уменьшение летальности Удлинение латентного периода судорог |
| Тиосемикарбазид (30 мг/кг внутрибрюшинно) | Ингибитор синтеза ГАМК (ингибитор глутаматдекарбоксилазы) | Уменьшение летальности Удлинение латентного периода судорог |
| Пилокарпин (350 мг/кг внутрибрюшинно) | М-холиномиметик | Удлинение латентного периода судорог (миоклонус головы) |
| Камфора (1000 мг/кг, внутрибрюшинно) | Аналептик, нарушение обмена моноаминов в ЦНС | Удлинение латентного периода судорог |
Наибольшую противоэпилептическую активность новый вальпроат проявлял при судорогах, индуцированных максимальным электрошоком, а также средствами, уменьшающими содержание ГАМК в головном мозге – антагонистом ГАМКА-рецепторов пентилентетразолом и ингибитором синтеза ГАМК изониазидом. Для данных моделей эпилепсии значения ED50 вальпразоламида (внутрибрюшинно, мыши) составили соответственно 138,4 (97,2÷197,2) мг/кг, 74,5 (46,8÷106,4) мг/кг и 126,8 (65,5÷245,4) мг/кг. При тиосемикарбазид-индуцированных судорогах у мышей новый вальпроат в дозе 150 мг/кг уменьшал летальность подопытных мышей на 37,5% по сравнению с контролем, что было сопоставимо с эффектами вальпроевой кислоты в дозе 200 мг/кг. При судорогах, индуцированных МЭШ и подкожным введением пентилентетразола значения терапевтического и протективного индексов вальпразоламида статистически значимо превышали аналогичные у вальпроевой кислоты (табл. 2).
Таблица 2. Противоэпилептическая активность вальпроевой кислоты и вальпразоламида при судорогах, индуцированных максимальным электрошоком и пентилентетразолом при подкожном введении у мышей
| Серия опытов | МЭШ ED50, мг/кг | МЭШ ТИ | МЭШ ПИ | ПТЗ ED50, мг/кг | ПТЗ ТИ | ПТЗ ПИ |
| ВК | 234,0 (181,4÷278,1) | 2,2 | 1,7 | 179,3 (137,8÷326,0) | 2,9 | 2,1 |
| ВПЗ | 138,4 (97,2÷197,2) | 6,7 | 3,3 | 74,5 (46,8÷106,4) | 12,4 | 6,1 |
Примечание: МЭШ – максимальный электрошок, ПТЗ – пентилентетразол, ED50 – средняя терапевтическая доза, ТИ – терапевтический индекс, ПИ – протективный индекс, ВК – вальпроевая кислота, ВПЗ – вальпразоламид.
В тестах антагонизма с пилокарпином и камфорой вальпразоламид статистически значимо удлинял латентный период первого судорожного приступа, однако не влиял на выживаемость подопытных животных.
Таким образом, сравнительный анализ фармакологической активности вальпразоламида и вальпроевой кислоты показал, что новый вальпроат обладал более выраженными противоэпилептическими свойствами и меньшей острой токсичностью по сравнению с референтным препаратом. Полученные данные согласуются с результатами других исследователей, изучавших модифицированные формы вальпроевой кислоты и 1,3,4-тиадиазолы с противоэпилептической активностью.
Наиболее простым по химическому строению модифицированным вальпроатом является вальпромид (2-пропилпeнтанaмид), представляющий собой амидированную форму вальпроевой кислоты. В тестах максимального электрошока и антагонизма с пентилентетразолом у мышей вальпромид был в среднем в 2-5 раз эффективнее вальпроевой кислоты, однако имел более выраженные седативные свойства и большую токсичность [16]. В исследованиях [17-18] показано, что амидирование карбоксильной группы вальпроевой кислоты приводило к снижению тератогенных свойств, что важно для клинической практики, так как одним из наиболее значимых побочных эффектов вальпроевой кислоты является ее тератогенность.
Наряду с замещенной амидной группой в структуре нового вальпроата имеется электронодонорный домен 1,3,4-тиадиазола. Среди производных 1,3,4-тиадиазола выявлено большое число соединений с выраженными противоэпилептическими свойствами [19-20]. Показано, что введение фрагмента 1,3,4-тиадиазола в структуру известного антиконвульсанта фенитоина приводило к повышению его противоэпилептической активности [21]. Известно, что многие 1,3,4-тиадиазоловые производные обладают меньшей токсичностью по сравнению с исходными веществами [22-23]. Приведенные данные показывают актуальность использования фармакофорного подхода к созданию новых противоэпилептических средств.
Выводы
1. Установлены фармакофоры, определяющие фармакологические свойства вальпроевой кислоты и вальпразоламида – ее нового 1,3,4-тиадиазолиламидного производного: они содержат в своей структуре гиброфобный домен (дистальный углеводородный радикал), с которым связано их противоэпилептическое действие.
2. Модификация вальпроевой кислоты путем введения дополнительных фармакофоров – замещенной амидной группы и электронодонорного фрагмента (1,3,4-тиадиазола) – привела к снижению острой токсичности и повышению противоэпилептической активности нового вальпроата.
Список литературы
1. Kalilani L., Sun Х, Pelgrims В. et al. The epidemiology of drug-resistant epilepsy: A systematic review and meta-analysis. Epilepsia 2018; 59 (12): 2179-2193.
2. Авакян Г.Н., Белоусова Е.Д., Бурд С.Г. и др. Проблемы эпилептологии. Ключевые приоритеты, задачи, вызовы и способы их решения. Эпилепсия и пароксизмальные состояния 2019; 11 (4): 395-406.
3. Krivoshein A.V. Antiepileptic Drugs Based on the α-Substituted Amide Group Pharmacophore: From Chemical Crystallography to Molecular Pharmaceutics. Curr Pharm Des. 2016; 22 (32): 5029-5040.
4. Pandeya S.N., Raja A.S., Stables J.P. Synthesis of isatin semicarbazones as novel anticonvulsants – role of hydrogen bonding. J Pharm Pharm Sci. 2002; 5 (3): 266-271.
5. Khan H.N., Kulsoom S., Rashid H. Ligand based pharmacophore model development for the identification of novel antiepileptic compound. Epilepsy Res. 2012; 98 (1): 62-71.
6. Tomson T., Battino D., Perucca E. The remarkable story of valproic acid. Lancet Neurol. 2016; 15(2): 141.
7. Perucca E. Pharmacological and therapeutical properties of valproate: a summary after 35 years of clinical experience. CNS Drugs 2012; 16 (10): 695-714.
8. Пат. 2651572 Российская Федерация, МПК А 61 К 31/433 N-(5-Этил-1,3,4-тиадиазол-2-ил)-2-пропилпентанамид, обладающий противоэпилептической и обезболивающей активностями. С.Я. Скачилова, А.С. Малыгин, Н.С. Попов [и др.]; заявитель и патентообладатель ОАО ВНЦ БАВ. – № 267288; заявл. 13.03.2018; опубл. 20.11.2018, Бюл. № 32. 8 с.
9. Malygin A.S., Demidova M.A., Skachilova S.Ya., Shilova E.V. Synthesis of a novel amide derivative of valproic acid and 1,3,4-thiadiazole with antiepileptic activity. Bulletin of RSMU. 2020; 1: 75-80.
10. Малыгин А.С. Исследование противоэпилептической активности нового амидного производного вальпроевой кислоты и 1,3,4-тиадиазола. Эпилепсия и пароксизмальные состояния 2019; 4: 357-363.
11. Малыгин А.С. Оценка острой токсичности и нейротоксичности нового амидного производного вальпроевой кислоты и 1,3,4-тиадиазола. Медицина 2019; 3: 37-46.
12. Приказ МЗ РФ от 01.04.2016 № 199н «Правила надлежащей лабораторной практики».
13. Европейская конвенция о защите позвоночных животных, используемых для экспериментов или в иных научных целях (Directive 2010/63/EU).
14. Миронов А.Н. Руководство по проведению доклинических исследований лекарственных средств. М.: Гриф и К., 2012. 944 с.
15. Kandratavicius L., Balista P., Lopes-Aguiar C. et al. Animal models of epilepsy: use and limitations. Neuropsychiatr Dis Treat. 2014; 10: 1693-1705.
16. Löscher W., Nau H. Pharmacological evaluation of various metabolites and analogues of valproic acid: anticonvulsant and toxic potencies in mice. Neuropharmacology 1985; 24(5): 427-435.
17. Okada A., Kurihara H., Aoki Y. et al. Amidic modification of valproic acid reduces skeletal teratogenicity in mice. Birth Defects Res B Dev Reprod Toxicol. 2004; 71(1): 47-53.
18. Radatz M., Ehlers K., Yagen B. et al. Valnoctamide, valpromide and valnoctic acid are much less teratogenic in mice than valproic acid. Epilepsy Res. 1998; 30(1):41-48.
19. Raj V., Rai A., Singh M. Recent Update on 1,3,4-Thiadiazole Derivatives: As Anticonvulsant Agents. American Research Journal of Pharmacy 2015; 1(1): doi: 10.21694/2380-5706.15005
20. Luszczki J.J., Kaspinska M., Matysiak J., Niewiadomy A. Characterization and preliminary anticonvulsant assessment of some 1,3,4-thiadiazole derivatives. Pharmacol Rep. 2015; 67(3): 588-592.
21. Botros S., Khalil N.A., Naguib B.H., El-Dash Y. Synthesis and anticonvulsant activity of new phenytoin. Eur J Med Chem. 2013; 60: 57-63.
22. Matysiak J. Biological and pharmacological activities of 1,3,4-thiadiazole based compounds. Mini-Reviews in Medicinal Chemistry 2015; 15 (9): 762-775.
23. Popov N., Demidova M., Malygin A. Assessment of pharmacological activity and bioavailability of the new derivative 1,3,4-thiadiazole. Research Results in Pharmacology 2018; 4(2): 27-46.
Pharmacophoric Analysis of the Structure of a New 1,3,4-Thiadiazolylamide Derivative of Valproic Acid
Authors
Malygin A. S.
Post-graduate student, Chair for Pharmacology and Clinical Pharmacology1
Yasnetsov V. V.
Doctor of Medicine, Leading Researcher, Chair for Experimental and Clinical Pharmacology2
1 - Tver State Medical University, Tver, Russia
2 - State Scientific Center of the Russian Federation – Institute of Medical and Biological Problems of the Russian Academy of Sciences, Moscow, Russia
Corresponding author
Malygin A.S.; e-mail: dr.a.s.m@yandex.ru
Conflict of interest
None declared.
Funding
The study had no sponsorship.
Abstract
Pharmacophoric analysis of the structure of valprazolamide, a 1,3,4-thiadiazolylamide derivative of valproic acid, was carried out. It was shown that the new valproate contains a substituted amide group, hydrophobic and electron-donor domеns – pharmacophores, determining its antiepileptic activity. Valproic acid has only a hydrophobic moiety. Modification of valproic acid by introducing an additional pharmacophore, 1,3,4-thiadiazole, into its structure leads to a decrease in toxicity and an increase in antiepileptic activity.
Key words
pharmacophoric analysis, valproic acid, 1,3,4-thiadiazole, antiepileptic activity
DOI
References
1. Kalilani L., Sun Х, Pelgrims В. et al. The epidemiology of drug-resistant epilepsy: A systematic review and meta-analysis. Epilepsia 2018; 59(12): 2179-2193.
2. Avakyan G.N., Belousova E.D., Burd S.G. et al. Problemy epileptologii. Klyuchevye prioritety, zadachi, vyzovy i sposoby ih resheniya. [Problems of epileptology. Key priorities, tasks, challenges and ways to address them.] Epilepsiya i paroksizmal'nye sostoyaniya [Epilepsy and paroxysmal conditions] 2019; 11 (4): 395-406. (In Russ.)
3. Krivoshein A.V. Antiepileptic Drugs Based on the α-Substituted Amide Group Pharmacophore: From Chemical Crystallography to Molecular Pharmaceutics. Curr Pharm Des. 2016; 22(32): 5029-5040.
4. Pandeya S.N., Raja A.S., Stables J.P. Synthesis of isatin semicarbazones as novel anticonvulsants – role of hydrogen bonding. J Pharm Pharm Sci. 2002; 5(3): 266-271.
5. Khan H.N., Kulsoom S., Rashid H. Ligand based pharmacophore model development for the identification of novel antiepileptic compound. Epilepsy Res. 2012; 98(1): 62-71.
6. Tomson T., Battino D., Perucca E. The remarkable story of valproic acid. Lancet Neurol. 2016; 15(2): 141.
7. Perucca E. Pharmacological and therapeutical properties of valproate: a summary after 35 years of clinical experience. CNS Drugs 2012; 16(10): 695-714.
8. Pat. 2651572 Rossijskaya Federaciya, MPK A 61 K 31/433 N-(5-Etil-1,3,4-tiadiazol-2-il)-2-propilpentanamid, obladayushchij protivoepilepticheskoj i obezbolivayushchej aktivnostyami. S.Ya. Skachilova, A.S. Malygin, N.S. Popov i dr.; zayavitel' i patentoobladatel' OAO VNC BAV. [Pat. 2651572 Russian Federation, IPC A 61 K 31/433 N- (5-Ethyl-1,3,4-thiadiazol-2-yl)-2-propylpentanamide, possessing antiepileptic and analgesic activities S.Ya. Skachilova, A.S. Malygin, N.S. Popov et al.; applicant and patentee of OJSC VNTs BAV.] № 267288; declared 03.13.2018; publ. 20.11.2018, Bul. 32. (In Russ.)
9. Malygin A.S., Demidova M.A., Skachilova S.Ya., Shilova E.V. Synthesis of a novel amide derivative of valproic acid and 1,3,4-thiadiazole with antiepileptic activity. Bulletin of RSMU 2020; 1: 75-80.
10. Malygin A.S. Issledovanie protivoepilepticheskoj aktivnosti novogo amidnogo proizvodnogo val'proevoj kisloty i 1,3,4-tiadiazola. [Investigation of antiepileptic activity of a new amide derivative of valproic acid and 1,3,4-thiadiazole.] Epilepsiya i paroksizmal'nye sostoyaniya [Epilepsy and paroxysmal conditions] 2019; 4: 357-363. (In Russ.)
11. Malygin A.S. Ocenka ostroj toksichnosti i nejrotoksichnosti novogo amidnogo proizvodnogo val'proevoj kisloty i 1,3,4-tiadiazola. [Evaluation of acute toxicity and neurotoxicity of a new amide derivative of valproic acid and 1,3,4-thiadiazole.] Medicine 2019; 3: 37-46. (In Russ.)
12. Prikaz MZ RF ot 01.04.2016 № 199n «Pravila nadlezhashchej laboratornoj praktiki» [Order of the Ministry of Health of the Russian Federation dated 01.04.2016 №199n «Rules of Good Laboratory Practice»]. (In Russ.)
13. Evropejskaya konvenciya o zashchite pozvonochnyh zhivotnyh, ispol'zuemyh dlya eksperimentov ili v inyh nauchnyh celyah (Directive 2010/63/EU). [European Convention for the Protection of Vertebrate Animals used for Experimental or Other Scientific Purposes (Directive 2010/63/EU)]. (In Russ.)
14. Mironov A.N. Rukovodstvo po provedeniyu doklinicheskih issledovanij lekarstvennyh sredstv. [Guidelines for conducting preclinical studies of drugs.] Moscow: Grif i K., 2012. (In Russ.)
15. Kandratavicius L., Balista P., Lopes-Aguiar C. et al. Animal models of epilepsy: use and limitations. Neuropsychiatr Dis Treat. 2014; 10: 1693-1705.
16. Löscher W., Nau H. Pharmacological evaluation of various metabolites and analogues of valproic acid: anticonvulsant and toxic potencies in mice. Neuropharmacology 1985; 24(5): 427-435.
17. Okada A., Kurihara H., Aoki Y. et al. Amidic modification of valproic acid reduces skeletal teratogenicity in mice. Birth Defects Res B Dev Reprod Toxicol. 2004; 71(1): 47-53.
18. Radatz M., Ehlers K., Yagen B. et al. Valnoctamide, valpromide and valnoctic acid are much less teratogenic in mice than valproic acid. Epilepsy Res. 1998; 30(1):41-48.
19. Raj V., Rai A., Singh M. Recent Update on 1,3,4-Thiadiazole Derivatives: As Anticonvulsant Agents. American Research Journal of Pharmacy 2015; 1(1): doi: 10.21694/2380-5706.15005
20. Luszczki J.J., Kaspinska M., Matysiak J., Niewiadomy A. Characterization and preliminary anticonvulsant assessment of some 1,3,4-thiadiazole derivatives. Pharmacol Rep. 2015; 67(3): 588-592.
21. Botros S., Khalil N.A., Naguib B.H., El-Dash Y. Synthesis and anticonvulsant activity of new phenytoin. Eur J Med Chem. 2013; 60: 57-63.
22. Matysiak J. Biological and pharmacological activities of 1,3,4-thiadiazole based compounds. Mini-Reviews in Medicinal Chemistry 2015; 15(9): 762-775.
23. Popov N., Demidova M., Malygin A. Assessment of pharmacological activity and bioavailability of the new derivative 1,3,4-thiadiazole. Research Results in Pharmacology 2018; 4(2): 27-46.