Авторы
Катаев С. С.
к.х.н., заведующий, судебно-химическое отделение1
Дворская О. Н.
к.ф.н., доцент, кафедра токсикологической химии2
Гофенберг М. А.
заведующая, химико-токсикологическая лаборатория34; старший преподаватель5
Дунилин А. В.
заведующий, химико-токсикологическая лаборатория6
1ГКУЗОТ «Пермское краевое бюро судебно-медицинской экспертизы», 614077, г. Пермь, ул. Старцева, 61.
2ФГБОУ ВО Пермская государственная фармацевтическая академия Министерства здравоохранения Российской Федерации, 614990, г. Пермь, ул. Полевая, 2.
3ГАУЗ СО «Областная наркологическая больница», 620030, г. Екатеринбург, ул. Халтурина, 44А.
4ГБУЗ СО «Свердловская областная клиническая психиатрическая больница», 620034, г. Екатеринбург, Сибирский тракт, 8км.
5ФГБОУ ВО «Уральский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Екатеринбург, ул. Репина, 3.
6ГБУ «Курганский областной наркологический диспансер», г. Курган, ул. Кирова, 78.
Автор для корреспонденции
Дворская Оксана Николаевна, e-mail: dvoksnik@gmail.com
Финансирование
Исследование не имело спонсорской поддержки.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Аннотация
Первые случаи выявления потребителей каннабимиметика MDMB-2201 при исследовании мочи на наркотические вещества в Российской Федерации произошли в марте-апреле 2019 года в городах Тюмень, Екатеринбург, Курган. В моче потребителей курительных смесей с использованием твердофазной экстракции и газовой хроматографии с масс-спектрометрическим детектированием выявлены 15 основных метаболитов и маркеров каннабимиметика MDMB-2201. Получены масс-спектры электронной ионизации выявленных метаболитов MDMB-2201, результаты расчетов ряда физико-химических характеристик и степени конъюгации метаболитов для установления фактов приема каннабимиметика MDMB-2201 при анализе изъятых биообъектов.
Ключевые слова
MDMB-2201, каннабимиметики, метаболиты, моча, твердофазная экстракция, газовая хроматография – масс-спектрометрия
Для цитирования
Катаев С. С., Дворская О. Н., Гофенберг М. А., Дунилин А. В. Изучение метаболического профиля каннабимиметика MDMB-2201 в моче методом газовой хроматографии с масс-спектрометрическим детектированием. Медицина 2019; 7(3): 104-120
DOI
Введение
Многие синтетические каннабимиметики, синтезированные в научных целях при поиске новых лекарственных средств, стали предметом неправомерного использования в качестве наркотических средств, способствуя, таким образом, расширению номенклатуры нелегальных веществ на рынке незаконного оборота наркотиков.
В ноябре 2016 года в Бельгии с использованием различных аналитических прикладных методов был идентифицирован новый каннабимиметик 5F-MDMB-PICA (MDMB-2201) в образцах порошка и "спайсов", поступивших в лабораторию на токсикологическое исследование [8]. С фармакологической точки зрения MDMB-2201 является мощным высокоэффективным агонистом каннабиноидных рецепторов (CB1 EC50 = 0.45 нМ; CB2 EC50 = 7.4 нМ) с преимущественной активацией рецепторов 1-го типа [4].
В работе Mogler с соавторами [7] представлены результаты исследования метаболизма MDMB-2201 in vivo на гепатоцитах печени человека и in vivo в моче потребителей с использованием ЖХ-МС/МС.
Первые случаи выявления потребителей каннабимиметика MDMB-2201 при исследовании мочи на наркотические вещества в Российской Федерации произошли в марте и апреле 2019 года в городах Тюмень, Екатеринбург, Курган.
Каннабимиметик MDMB-2201, как производное метилового эфира 3-метил-2-(1-пентил-1H-индол-3-карбоксамидо) бутановой кислоты, отнесен к I Списку Постановления Правительства РФ № 578 от 23.06.2014 [3]. MDMB-2201 является аналогом известного соединения MDMB(N)-2201 [4-6] и отличается от последнего наличием индольного гетероцикла, вместо индазольного в структуре MDMB(N)-2201. Структурные формулы каннабимиметиков MDMB-2201 и MDMB(N)-2201 представлены на рисунке 1.
Рис. 1. Структурные формулы каннабимиметиков MDMB-2201 и MDMB(N)-2201

Учитывая высокую вероятность географического распространения MDMB-2201 и необходимость его идентификации в биологических объектах с целью установления фактов употребления, изучение метаболического профиля мочи нового каннабимиметика MDMB-2201 является важным для работы экспертных лабораторий.
Целью работы является изучение метаболического профиля каннабимиметика MDMB-2201 в моче для целей скрининга с использованием твердофазной экстракции и газовой хроматографии с масс-спектрометрическим детектированием (ГХ/МС).
Используемое оборудование, объекты и методы исследования
● Газовый хроматограф с масс-спектрометром Agilent 7820/5975 с колонкой НР-5MS (Agilent, США);
● вакуумный манифолд на 12 образцов (Supelco);
● вакуумный насос KNF lab LABOPORT (Франция);
● термоблок ПЭ-4030 (Россия);
● испаритель одноканальный ПЭ-2300 (Россия);
● микровстряхиватель ПЭ-2 (Россия);
● СВЧ печь Supra MWS-1824SW (Россия);
● патроны SampliQ EVIDEX (200 мг,3 мл) (Agilent, США);
● пипетки-дозаторы полуавтоматические для отбора жидкостей (4-40, 40-200 мкл, 0,2-1, 1-5 мл).
● Семь проб мочи, поступивших в химико-токсикологическую лабораторию от пациентов отделения острых отравлений и освидетельствуемых на состояние опьянения.
В исследовании применялись растворители и реактивы чистоты "хч". Образцы мочи до исследования хранились в холодильнике при + 4 оС.
Пробоподготовка [1]. Пробоподготовка образцов мочи (с ферментативным гидролизом): к 1 мл мочи добавляли по 50 мкл этанольных растворов внутренних стандартов: гидрохлорид этилморфина (0,02 мг/мл), гексенал (0,2 мг/мл), N-этилбензиламин (0,01 мг/мл). Для одной параллели проб мочи (с ферментативным гидролизом): к пробе мочи добавляли 250 мкл 0,067 М буфера фосфатного (pH 6) и 50 мкл β-глюкуронидазы и выдерживали 2 часа при 45о С.
В образцы мочи (с гидролизом и без) вносили 2 мл 0,067 М буфера фосфатного (рН 4.8). После центрифугирования при 3000 об / мин (10 минут) супернатант отделяли от осадка.
Сорбент патрона для ТФЭ (смешанная фаза) кондиционировали, пропуская по 2 мл 95% этанола и 0,067 М буфера фосфатного (рН 4.8), пропускали образец (скорость – 1 мл/мин). Для промывки использовали 1 мл 0,067 М буфера фосфатного с рН 4.8, 1 мл 10% этанола. Сушка патрона – под вакуумом (20 минут). Получали два элюата: дважды по 2 мл пропускали элюент гексан – этилацетат (2:1), при этом получали I элюат. Затем при двукратном пропускании через патрон по 2 мл элюента метиленхлорид – 2-пропанол – 25% раствор аммиака (2:1:0.1) получали II элюат. Оба элюата испаряли при 45о С в токе азота.
Дериватизация [1]. Получение метильных производных. К сухому остатку первого элюата вносили 500 мкл ацетона безводного, 40 мкл метилиодида, 20-25 мг карбоната калия безводного, нагревали в термоблоке 60 минут при 60о С после герметичного укупоривания. Жидкую фракцию смеси после охлаждения флакона отбирали в чистую виалу, испаряли при 40о С в токе азота. Сухой остаток реконструировали в 100 мкл этилацетата безводного.
Получение ацетильных производных. К сухому остатку II элюата или I элюата (последний после процедуры метилирования) добавляли 40 мкл пиридина безводного, 60 мкл ангидрида уксусного, замывая стенки виалы; укупоренную виалу на 5 минут помещали в СВЧ-печь с мощностью 560 Вт. После охлаждения флакона избыток реагентов удаляли не выше 40о С в токе азота. Сухой остаток реконструировали в 100 мкл этилацетата безводного.
Триметилсилилирование. К сухому остатку I или II элюатов вносили 100 мкл BSTFA (с 1% триметилхлорсиланом), перемешивали на микровстряхивателе после герметичной укупорки, выдерживали в термоблоке в течение часа при 80о С. После охлаждения виалы 2 мкл вводили в испаритель газового хроматографа.
Режим работы ГХ/МС. Поток гелия (газ-носитель) через колонку со скоростью 1,5 мл/мин, испаритель хроматографа работал в режиме split/splitless (при делении потока – 15:1, задержка включения после ввода пробы – 1 мин). Температуры интерфейса детектора и испарителя хроматографа устанавливалась 280 и 250о С, соответственно. Температура колонки: начальная 70о С (2 мин), прогрев до 280о С (скорость программирования – 20 град/мин, 8 мин. – выдержка при конечной температуре). Напряжение на умножителе детектора соответствует показателю автоматической настройки детектора.
Масс-спектры ацетильных и метильных дериватов (при полном сканировании ионов) регистрировали в интервале масс 42-450 Да. Масс-спектры триметилсилильных дериватов (при полном сканировании ионов) регистрировали в интервале масс 43-650 Да.
Идентификация компонентов проб была проведена с применением программ MSD ChemStation E.02.01.1177 (Agilent) и AMDIS.
Долю конъюгирования метаболитов MDMB-2201 для их метиловых эфиров определяли по величине отношения площади пиков иона с величиной m/z: для М 1 и артефакта М8 – 232, M2 и артефакта М9– 230, М3 – 158, М4 – 262, М6 и артефакта М5 – 258, М7.1, М7.2 и М10 – М12 – 188, М13.1 и М13.2 – m/z 248 к площади пика иона m/z 235 для внутреннего стандарта N-метилгексенала в I элюате мочи (с гидролизом и без). Содержание М1 было принято за 100%, расчет значения прочих метаболитов проведен по соотношению площади пиков характеристических ионов со 100% интенсивностью в масс-спектре метаболитов.
Расчет констант (LogP, KOC) проведен с применением пакета программ ACD/Labs v6.0.
Результаты и обсуждение
Химическое название каннабимиметика MDMB-2201 – 2-[1-(5-фторпентил)-1H-индол-3-карбоксамид]-3,3-диметилбутановой кислоты метиловый эфир; брутто формула: C21H29FN2O3; молекулярная масса = 376 г/моль. CAS № 1971007-88-1 Синонимы: 5-fluoro-MDMB-2201, 5-fluoro MDMB-PICA.
Структурные формулы предполагаемых метаболитов MDMB-2201, выявленных в реальных пробах мочи, представлены на рисунке 2.
Структуры метаболитов определяли на основании данных масс-фрагментации пиков на хроматограммах при анализе мочи потребителей наркотических средств с учетом характерных закономерностей. Для установления типа функциональных групп, имеющихся в структуре метаболитов, получали различные производные метаболитов.
На рисунках 3-15 приведены структурные формулы, масс-спектры и аналитические характеристики ряда полученных производных метаболитов MDMB-2201.
Рис. 2. Структурные формулы метаболитов MDMB-2201

Рис. 3. Структура, масс-спектр и аналитические характеристики метилового эфира метаболита М1

Рис. 4. Структура, масс-спектр и аналитические характеристики диметилового эфира метаболита М2

Рис. 5. Структура, масс-спектр и аналитические характеристики диметильного производного М3

Рис. 6. Структура, масс-спектр и аналитические характеристики диметилового эфира метаболита М4

Рис. 7. Структура, масс-спектр и аналитические характеристики артефакта метилового эфира метаболита М5

Рис. 8. Структура, масс-спектр и аналитические характеристики диметилового эфира метаболита М6

Рис. 9. Структура, масс-спектр и аналитические характеристики триметильных производных метаболитов М7.1 и М7.2

Рис. 10. Структура, масс-спектр и аналитические характеристики артефакта метаболита М8

Рис. 11. Структура, масс-спектр и аналитические характеристики артефакта метилового эфира метаболита М9
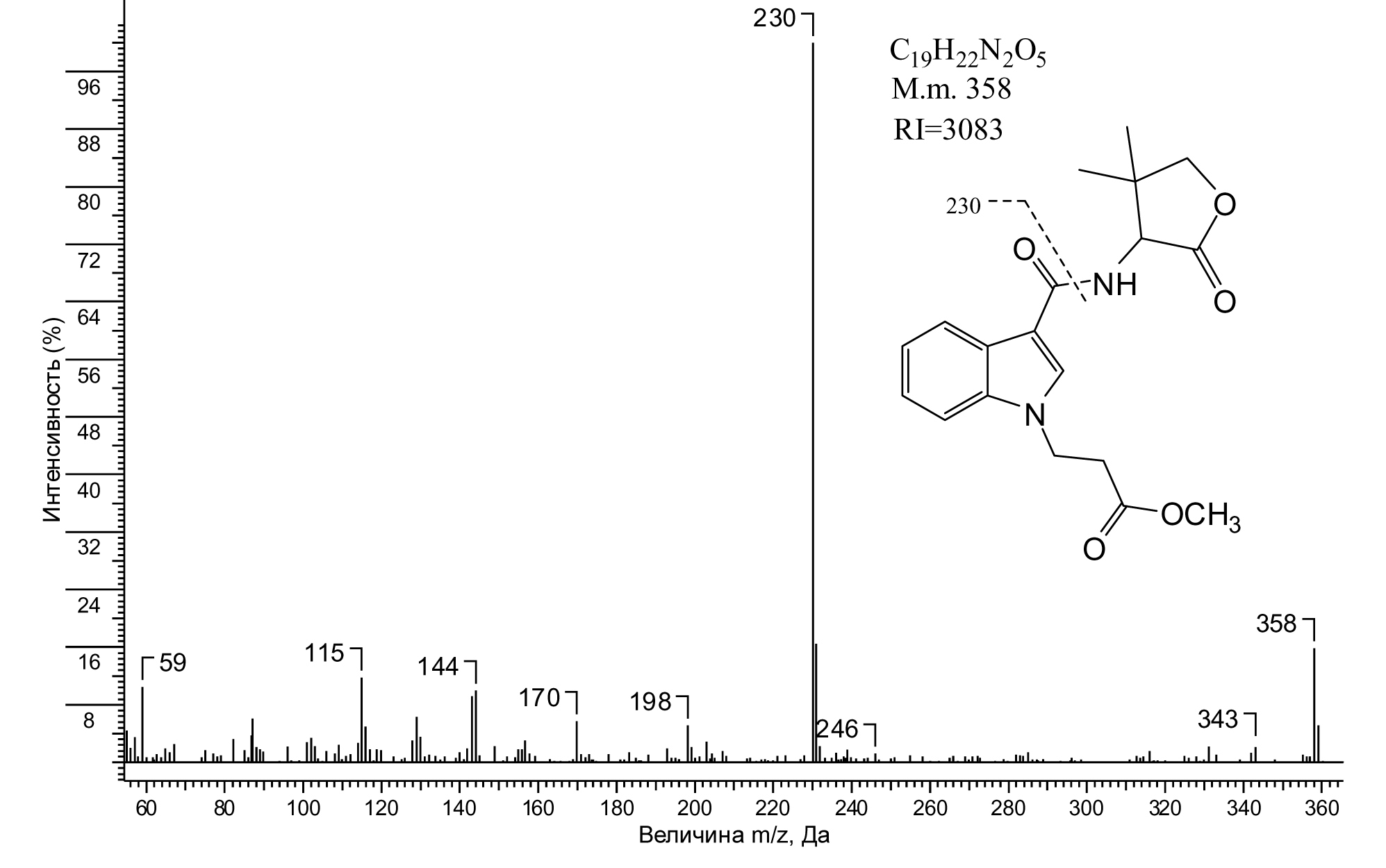
Рис. 12. Структура, масс-спектр и аналитические характеристики метильного эфира метаболитов М13.1 и М13.2

Рис. 13. Структура, масс-спектр и аналитические характеристики метилового эфира метаболитов М13.1 и М13.2 после ацетилирования

Рис. 14. Структура, масс-спектр и аналитические характеристики триметилсильного эфира метаболита М1

Рис. 15. Структура, масс-спектр и аналитические характеристики бис-триметилсилильного производного М3

При исследовании проб с применением различных видов дериватизации метилированием и последующим ацетилированием в двух образцах мочи были идентифицированы метаболиты М13.1 и М13.2, имеющие в структуре соединений спиртовую гидроксильную группу в N-алкильном заместителе.
В масс-спектрах метильных производных и артефактов метаболитов MDMB-2201 присутствует молекулярный ион-радикал и ион со 100% интенсивностью, образованный разрывом сигма-связи функциональной группы (амидной или сложноэфирной для М10 – М12) в положении 3. Общим направлением фрагментации, характерным для метиловых эфиров, за исключением метаболитов М10 – М12, является отщепление 2-метилпроп-1-ена, образующегося из трет-бутильного фрагмента с получением ион-радикала [М-56]+.
Необходимость проведения гидролиза (ферментативного или щелочного) на предварительной стадии анализа определяется высокой долей конъюгирования маркеров каннабимиметиков; в силу липофильности маркеров их можно выделять, применяя различные гидрофобные сорбенты, либо сорбенты смешанного типа. Последние дают возможность проводить определение маркеров каннабимиметиков в скрининге мочи при поиске наркотических и лекарственных веществ [7].
При использовании на стадии пробоподготовки ТФЭ проведено фракционирование аналитов на фракции кислотного/основного характера. Все выявленные метаболиты MDMB-2201 обнаружены в первом элюате.
При исследовании семи проб мочи потребителей MDMB-2201 исходное соединение обнаружено не было. В анализируемых образцах выявлено 15 метаболитов фазы I биотрансформации MDMB-2201, что свидетельствует об интенсивном метаболизме данного каннабимиметика в организме человека.
В таблице 1 приведены результаты расчета Log P, Koc (pH=4.8) и оценки относительного содержания, а также степени конъюгации метаболитов MDMB-2201. Из представленных данных видно, что основная доля метаболитов фазы I биотрансформации каннабимиметика элиминируется с мочой в виде конъюгатов, что обусловлено их значительной липофильностью.
Таблица 1. Характеристика каннабимиметика MDMB-2201 и его основных метаболитов (n-количество образцов, где было обнаружено соединение)

Основным направлением метаболизма MDMB-2201 является гидролиз сложноэфирной группы с образованием метаболита М1. Последний может быть использован в качестве маркера употребления MDMB-2201 при скрининговом анализе мочи с применением метода ГХ/МС. Значительное содержание наблюдается так же для N-дезалкильного метаболита М3. Прочие метаболиты определяются в моче в незначительных количествах. Метаболиты MDMB-2201 с сохранением сложноэфирной связи в исследованных образцах мочи не выявлены.
Метаболиты М10 – М12, образующиеся в результате гидролиза амидной группы в положении 3 индольного гетероцикла, идентичны мочевым метаболитам потребителей PB-22F [8].
Метиловые эфиры метаболитов М5, М8, М9, будучи термолабильными, при ГХ/МС исследовании образуют лактоны (артефакты) вследствие процесса внутримолекулярной циклизации.
Заключение
В процессе изучения метаболического профиля с использованием ТФЭ и метода ГХ/МС идентифицированы 15 основных метаболитов и маркеров синтетического каннабимиметика MDMB-2201 в моче его потребителей. Основные направления биотрансформации связаны с гидролизом сложноэфирной группы, реакцией N-дезалкилирования и образованием моногидроксилированных производных, которые выводятся с мочой, преимущественно, в конъюгированном виде. Приведены масс-спектры электронной ионизации идентифицированных метаболитов MDMB-2201, результаты расчетов некоторых физико-химические характеристик и степени конъюгации метаболитов. Полученные данные позволяют использовать их при скрининге биологических объектов на наличие синтетических каннабимиметиков.
Список литературы
1. Дворская О.Н., Катаев С.С., Мелентьев А.Б. Идентификация маркеров некоторых синтетических каннабиноидов в биологических объектах: Информационное письмо рекомендовано к изданию Ученым советом ФГБУ РЦСМЭ Минздрава России (протокол № 1 от 17 марта 2017 г.). Ижевск. 34 с.
2. Катаев, С.С., Дворская О.Н. Идентификация метаболитов каннабимиметика PB-22F в моче. Бутлеровские сообщения 2014; 37 (2): 114-121.
3. О внесении изменений в некоторые акты Правительства Российской Федерации в связи с совершенствованием контроля за оборотом наркотических средств. Постановление Правительства Российской Федерации от 23.06.2014 г. N 578. URL: http://www.consultant.ru/document/cons_doc_LAW_164873/
4. Banister S.D., Longworth M., Kevin R., Sachdev S., Santiago M., Stuart J., Mack J.B., Glass M., McGregor I.S., Connor M., Kassiou M. Pharmacology of Valinate and tert-Leucinate synthetic cannabinoids 5F-AMBICA, 5F-AMB, 5F-ADB, AMB-FUBINACA, MDMB-FUBINACA, MDMB-CHMICA, and their analogues. ACS Chem. Neurosci. 2016; 7 (9): 1241-54. doi: 10.1021/acschemneuro.6b00137
5. Hasegawa K., Wurita A., Minakata K., Gonmori K., Yamagishi I., Nozawa H., Watanabe K., Suzuki O. Identification and quantification of 5-fluoro-ADB, one of the most dangerous synthetic cannabinoids, in the stomach contents and solid tissues of a human cadaver and in some herbal products. Forensic Toxicol. 2015; 33 (1): 112-21.
6. Kaneko S. Motor vehicle collisions caused by the 'super-strength' synthetic cannabinoids, MAM-2201, 5F-PB-22, 5F-AB-PINACA, 5F-AMB and 5F-ADB in Japan experienced from 2012 to 2014. Forensic Toxicol. 2017; 35 (2): 244-51.
7. Mogler L., Franz F., Rentsch D., Angerer V., Weinfurtner G., Longworth M., Banister S.D, Kassiou M., Moosmann B., Auwärter V. Detection of the recently emerged synthetic cannabinoid 5F-MDMB-PICA in 'legal high' products and human urine samples. Drug Test Anal. 2018; 10 (1): 196-205. doi: 10.1002/dta.2201
8. Risseeuw M.D.P., Blanckaert P., Coopman V., Van Quekelberghe S., Van Calenbergh S., Cordonnier J. Identification of a new tert-leucinate class synthetic cannabinoid in powder and «spice-like» herbal incenses: Methyl 2-1-(5-fluoropentyl)indole-3-carbonyl]amino]-3,3-dimethyl-butanoate (5F-MDMB-PICA). Forensic Sci Int. 2017; 273: 45-52. doi: 10.1016/j.forsciint.2017.01.023
The study of the metabolic profile of cannabimimetic MDMB-2201 in urine using gas chromatography with mass spectrometric detection
Authors
Kataev S. S.
PhD, Head, Forensic Chemistry Department1
Dvorskaya O. N.
PhD, Assistant Professor, Chair for Toxicological Chemistry2
Gofenberg M. A.
Head, Chemical and Toxicological Laboratory34; Senior Lecturer5
Dunilin A. V.
Head, Chemical and Toxicological Laboratory6
1 - Perm Regional Bureau of Forensic-Medical Expertise, Perm, Russia
2 - Perm State Pharmaceutical Academy, Perm, Russia
3 - Yekaterinburg Regional Narcological Clinic, Yekaterinburg, Russia
4 - Sverdlovsk Regional Clinical Psychiatric Hospital, Yekaterinburg, Russia
5 - Ural State Medical University, Yekaterinburg, Russia.
6 - Kurgan Regional Narcoligical Clinic, Kurgan, Russia.
Corresponding Author
Dvorskaya Oksana, e-mail: dvoksnik@gmail.com
Funding
The study had no sponsorship.
Conflict of interest
The authors declare no conflict of interest.
Abstract
The first cases of identifying consumers of cannabimimetics MDMB-2201 during urine testing for narcotic substances in the Russian Federation were registered in March-April 2019 in the cities of Tyumen, Yekaterinburg, and Kurgan., 15 main metabolites and markers of the cannabimimetic MDMB-2201 were identified in the urine of consumers of smoking mixtures using solid-phase extraction and gas chromatography with mass spectrometric detection. Mass spectra of electronic ionization of the identified metabolites of MDMB-2201 were obtained, the results of calculations of several physicochemical characteristics and the degree of conjugation of metabolites to establish the facts of taking the cannabimimetic MDMB-2201 in the analysis of obtained biologic objects are presented.
Key words
MDMB-2201, cannabimimetics, metabolites, urine, solid-phase extraction (SPE), gas chromatography – mass spectrometry (GC-MS)
DOI
References
1. Kataev S.S., Dvorskaya O.N., Melent’ev A.B. Identifikatsiya markerov nekotorykh sinteticheskikh kannabinoidov v biologicheskikh ob’yektakh: informatsionnoye pis'mo. [Identification of markers of some synthetic cannabinoids in biological objects: Information letter]. Izhevsk. 2017: 34 p. (In Russ.)
2. Kataev S.S., Dvorskaya O.N. Identifikaciya metabolitov kannabimimetika PB-22F v moche [Identification of PB-22F cannabimimetics’ metabolites in urine]. Butlerovskie soobshcheniya [Butlerov Communications] 2014; 37 (2): 114-21. (In Russ.)
3. O vnesenii izmeneniy v nekotoryye akty Pravitel'stva Rossiyskoy Federatsii v svyazi s sovershenstvovaniyem kontrolya za oborotom narkoticheskikh sredstv: postanovleniye Pravitel'stva Ros. Federatsii ot 23.03.2015 № 578 [On introducing changes to certain cuts of the Government of the Russian Federation due to the improvement of control over the circulation of narcotic drugs: Decree of the Government of Russian Federation from 23 Mar 2015 No 1097]. Available from: http:// www.consultant.ru/document/cons_doc_LAW_164873/ (In Russ.)
4. Banister S.D., Longworth M., Kevin R., Sachdev S., Santiago M., Stuart J., Mack J.B., Glass M., McGregor I.S., Connor M., Kassiou M. Pharmacology of valinate and tert-leucinate synthetic cannabinoids 5F-AMBICA, 5F-AMB, 5F-ADB, AMB-FUBINACA, MDMB-FUBINACA, MDMB-CHMICA, and their analogues. ACS Chem. Neurosci. 2016;7(9):1241-54. doi: 10.1021/acschemneuro.6b00137
5. Hasegawa K., Wurita A., Minakata K., Gonmori K., Yamagishi I., Nozawa H., Watanabe K., Suzuki O. Identification and quantification of 5-fluoro-ADB, one of the most dangerous synthetic cannabinoids, in the stomach contents and solid tissues of a human cadaver and in some herbal products. Forensic Toxicol. 2015; 33 (1): 112-21.
6. Kaneko S. Motor vehicle collisions caused by the 'super-strength' synthetic cannabinoids, MAM-2201, 5F-PB-22, 5F-AB-PINACA, 5F-AMB and 5F-ADB in Japan experienced from 2012 to 2014. Forensic Toxicol. 2017; 35 (2): 244-51.
7. Mogler L., Franz F., Rentsch D., Angerer V., Weinfurtner G., Longworth M., Banister S.D, Kassiou M., Moosmann B., Auwärter V. Detection of the recently emerged synthetic cannabinoid 5F-MDMB-PICA in 'legal high' products and human urine samples. Drug Test Anal. 2018; 10 (1): 196-205. doi: 10.1002/dta.2201.
8. Risseeuw M.D.P, Blanckaert P., Coopman V., Van Quekelberghe S., Van Calenbergh S., Cordonnier J. Identification of a new tert-leucinate class synthetic cannabinoid in powder and «spice-like» herbal incenses: Methyl 2-1-(5-fluoropentyl)indole-3-carbonyl]amino]-3,3-dimethyl-butanoate (5F-MDMB-PICA). Forensic Sci Int. 2017; 273: 45-52. doi: 10.1016/j.forsciint.2017.01.023.