| О журнале | Редколлегия | Редсовет | Архив номеров | Поиск | Авторам | Рецензентам | English |
Тяжелое поражение роговицы при эндокринной офтальмопатии. Клинический случай и краткий обзор литературы.
Автор для корреспонденции: Исмаилова Диляра Султанмуратовна: е-mail: d_ismailova@bk.ru. Финансирование. Работа не имела спонсорской поддержки. Конфликт интересов. Автор заявляет об отсутствии конфликта интересов. Аннотация В статье представлен случай тяжелого поражения роговицы при эндокринной офтальмопатии (ЭОП). Описаны методы хирургического и медикаментозного лечения, применявшиеся на различных этапах. В результате проведенного комбинированного лечения достигнута длительная стабилизация процесса и ремиссия ЭОП. Коротко проанализирована отечественная и иностранная литература, касающаяся вопросов этиологии, патогенеза, факторов риска и лечения кератопатии у пациентов с эндокринной офтальмопатией. Лечение пациентов с поражением роговицы при ЭОП может быть различным, зачастую комбинированным, с учетом множества факторов. Выбор лечебных мероприятий зависит, прежде всего, от активности орбитального воспаления, величины экзофтальма и степени выраженности изменений роговицы. Хирургическая составляющая лечения может включать в себя проведение декомпрессии орбиты, коррекцию лагофтальма и ретракции век, биопокрытие роговицы, коррекцию косоглазия и другие вмешательства. Ключевые слова эндокринная офтальмопатия, язва роговицы, синдром сухого глаза, ретракция век, лагофтальм, декомпрессия орбиты, пульс-терапия, тарзорафия doi: 10.29234/2308-9113-2019-7-1-16-25 Введение Эндокринная офтальмопатия – прогрессирующее заболевание мягких тканей орбиты, в основе которого лежит иммуномедиаторное воспаление экстраокулярных мышц и орбитальной клетчатки. Патологический процесс в орбите развивается на фоне нарушения функции щитовидной железы и относится к заболеваниям с хроническим течением и неблагоприятным зрительным и косметическим прогнозом [1]. Агрессивное течение эндокринной офтальмопатии характерно только для отечного экзофтальма, это связано с крайне быстрым нарастанием клинических симптомов и быстрым падением зрения вследствие обширного поражения роговицы (роговичный вариант отечного экзофтальма), либо развития оптической нейропатии (вариант отечного экзофтальма с оптической нейропатией) [1]. При отсутствии адекватного лечения эндокринная офтальмопатия приводит к инвалидизации больных в результате стойкого нарушения функций органа зрения, а при поражении роговицы с ее расплавлением возможна не только потеря зрения, но и глаза. В качестве иллюстрации тяжелого поражения роговицы при декомпенсации отечного экзофтальма приводим собственное наблюдение. Клинический случай Больной С, 1962 г. рождения, обратился в НИИ глазных болезней (НИИ ГБ) с жалобами на снижение зрения левого глаза, выпячивание и покраснение глаз, боли за глазами. Пациент заболел 8 месяцев назад, когда появился экзофтальм слева, который уменьшился в течение 2-3 недель без какого-либо лечения. Через месяц вновь появился экзофтальм слева, а также резкая слабость и парестезии в ногах, затрудняющие движения. Через 2 месяца пациент был госпитализирован в реанимационное отделение ГКБ им. С.П. Боткина. В течение 20 дней больной находился в коме, была произведена трахеостомия. Состояние было расценено как тиреотоксический криз. В течение всего времени госпитализации у пациента отмечался выраженный двусторонний экзофтальм. По поводу диагностированного гипертиреоза пациент получал мерказолил по 15 мг/сут. В составе комплексной терапии использовали внутривенное введение глюкокортикоидов (суммарная доза неизвестна). Эндокринологом по месту жительства был назначен преднизолон внутрь, стартовая доза составила 30 мг/сут, с последующим постепенным снижением дозировки до полной отмены (суммарная доза за 40 суток составила 832,5 мг). При поступлении в стационар НИИ ГБ жалобы на резкую боль за глазами (больше слева), снижение зрения, покраснение глаз, светобоязнь, слезотечение. Острота зрения правого глаза – 0,6 н/к, левого глаза – 0,1 н/к; на обоих глазах пальпаторно ВГД повышено (Т+). Двусторонний экзофтальм. Движения правого глаза резко ограничены, левого глаза – отсутствуют, репозиция обоих глаз невозможна; выраженные периорбитальные отеки, кожа век напряжена, ретракция век, лагофтальм справа 6 мм, слева 9 мм; выраженный (больше слева) красный хемоз. Правый глаз: эпителиопатия в верхней части роговицы, на 4-5 часах полулунной формы язва, доходящая до 1/3 стромы (рис.1) Левый глаз: эпителиопатия роговицы в верхней части, в нижней половине – полулунной формы глубокая язва, достигающая середины стромы (рис. 2). В стационаре больному была проведена терапия метипредом в/в 1000мг № 5, после достижения положительной динамики произведена операция: на левом глазу – биопокрытие роговицы донорским послойным кератосклеральным трансплантатом; на обоих глазах – жировая декомпрессия орбиты; покрытие аутоконъюнктивой по Кунту; некровавая блефарорафия. На фоне лечения отмечалась выраженная положительная динамика. Рис. 1. Правый глаз. Эрозия роговицы. а – диффузное освещение; б – окраска флуоресценом. 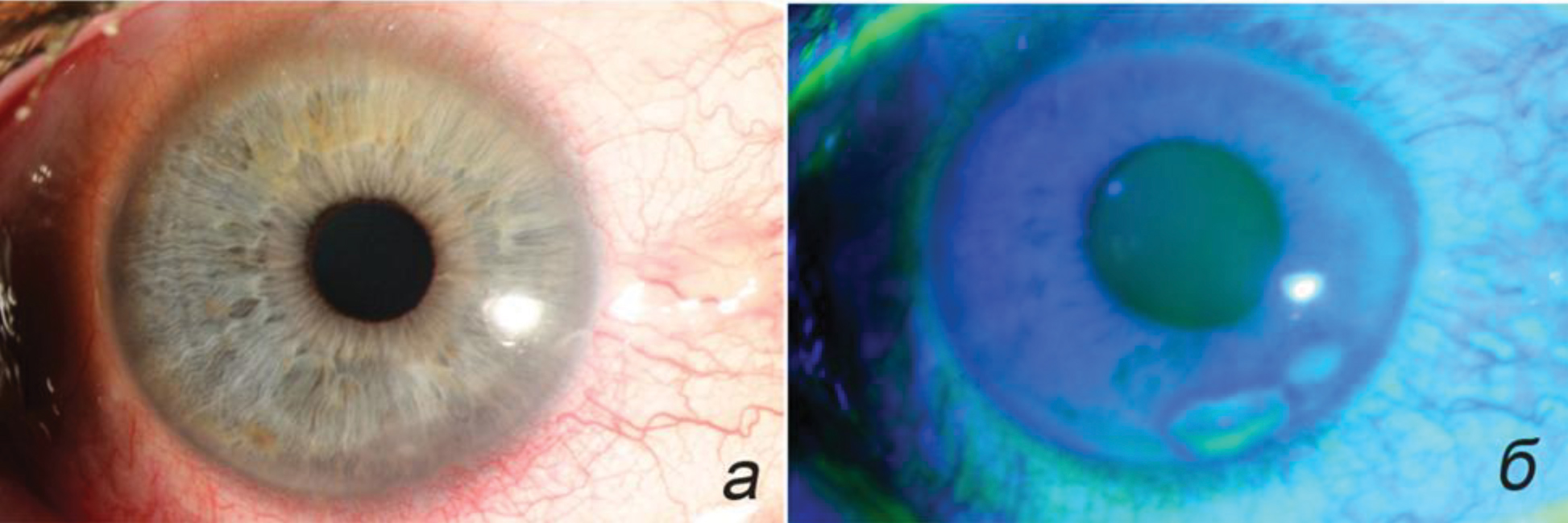 Рис. 2. Левый глаз. Эрозия роговицы. а – диффузное освещение; б – окраска флуоресценом. 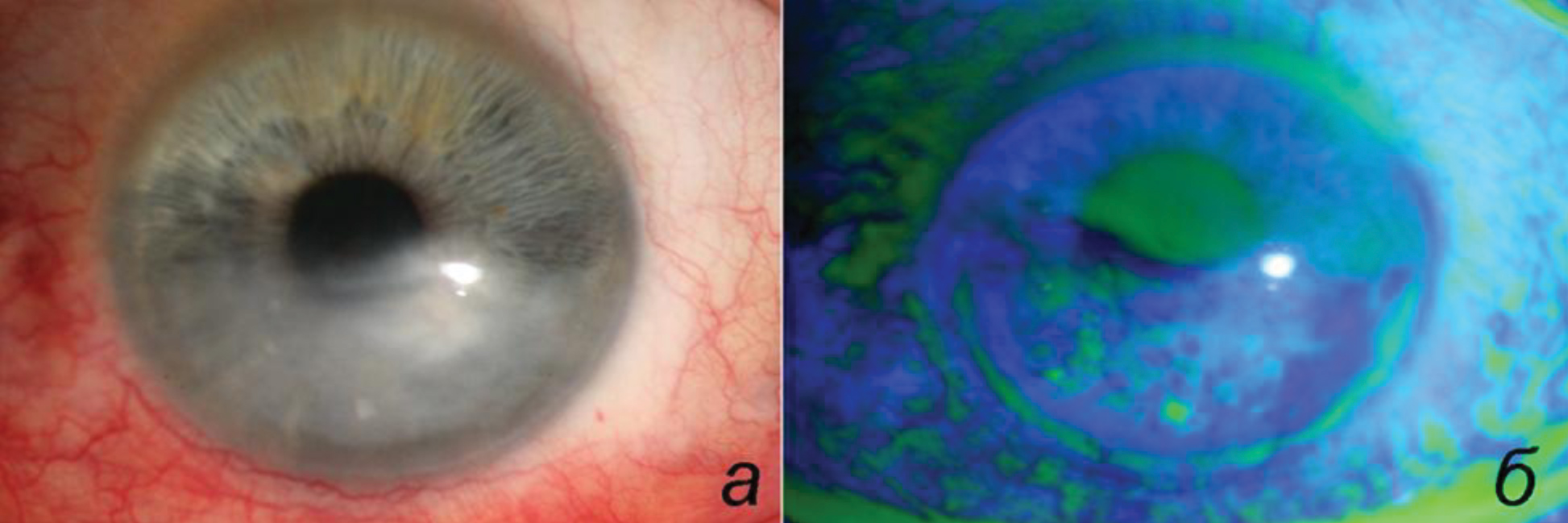 Однако декомпенсация орбитального процесса и рецидив язвы на левом глазу потребовали повторной госпитализации через 2 месяца. При поступлении: острота зрения правого глаза 1,0, левого – 0,1 н/к; пальпаторно ВГД нормальное; осевой экзофтальм справа 23 мм, слева – 24 мм, репозиция обоих глаз резко затруднена, подвижность значительно ограничена; периорбитальный отек. Эрозия роговицы на 5-7 часах справа, корнеосклерального послойного трансплантата, васкуляризация собственной роговицы слева. С обеих сторон отмечалась ретракция век и лагофтальм. Пациенту было произведено удлинение леватора верхнего века лоскутом гомосклеры на обоих глазах, повторное удаление орбитальной клетчатки слева. В результате проведенного лечения острота зрения не изменилась, ширина глазной щели справа уменьшилась, появилась слабая репозиция глаза слева. На роговице правого глаза в нижней ⅓ сформировалось помутнение, на левом глазу остановлено расплавление послойного трансплантата, васкуляризация собственной роговицы. Через 2 месяца пациент вновь поступил в стационар в связи с лизисом послойного корнеосклерального трансплантата слева и оптической нейропатией на обоих глазах. При поступлении: острота зрения правого глаза 1,0; левого – 0,01 эксцентрично, н/к. Оба глаза – осевой экзофтальм справа 24 мм, слева 26 мм; репозиция затруднена, выраженный периорбитальный отек. Правый глаз: лагофтальм 2 мм; умеренный хемоз, в нижней ⅓ роговицы роговично-конъюнктивальное сращение по типу псевдоптеригиума. Левый глаз: лагофтальм – 8 мм, красный хемоз, выраженный отек слезного мясца, лизис корнеосклерального послойного трансплантата, васкуляризация собственной роговицы. Глубжележащие среды не видны. При компьютерной периметрии на правом глазу выявлены единичные парацентральные скотомы. По поводу лизиса корнеосклерального трансплантата на левом глазу произведено покрытие роговицы амнионом, замковая полная тарзорафия. Справа была выполнена латеральная кровавая тарзорафия. Начат курс пульс-терапии метипредом по схеме А.Ф. Бровкиной [1]. В результате лечения было достигнуто значительное улучшение состояния. Амбулаторно пациент продолжал терапию глюкокортикоидами по схеме. Позже был проведен курс дистанционной гамма-терапии (ДГТ; суммарная доза 10 Гр на каждую орбиту), после чего полностью ушли периорбитальные отеки, хемоз. В результате была достигнута стабилизация орбитального процесса. При осмотре правый глаз – острота зрения 1,0; ВГД пальпаторно нормальное, экзофтальм 19 мм, незначительное ограничение подвижности глаза кнаружи, лагофтальм 1мм; конъюнктива спокойная, роговица прозрачная, на 5-7 часах вдоль лимба васкуляризированное помутнение. Глубжележащие среды без патологических изменений. Левый глаз: острота зрения 0,1 н/к (эксцентрично), ВГД пальпаторно нормальное, экзофтальм 21 мм, глазная щель зашита на 2/3 снаружи; конъюнктива спокойна, видимая роговица васкуляризирована, в центре помутнение. В течение двух лет последующего наблюдения достигнутый результат оставался стабильным. Пациент отказался от "расшивания" левого глаза. Обсуждение Одним из наиболее тяжелых, приводящих к значительному снижению зрения осложнений эндокринной офтальмопатии (ЭОП) является поражение роговицы. Среди причин, приводящих к поражению роговицы, основную роль играют следующие: неполное смыкание век, увеличенная ширина глазной щели, экзофтальм, ретракция век, синдром сухого глаза, нарушение чувствительности роговицы, аномальный мигательный рефлекс, отставание верхнего века, отсутствие феномена Белла. При воздействии нескольких факторов одновременно поражение роговицы при ЭОП приобретает особо тяжелое течение. Одной из ведущих причин, обусловливающих поражение роговицы при ЭОП, является синдром "сухого глаза" (ССГ). По данным различных исследователей, этот синдром развивается у 45-85% больных с ЭОП в зависимости от стадии заболевания [15]. Однако изменения конъюнктивы при этом не носят специфического характера при ЭОП [5,14]. Сухость поверхности глазного яблока может быть вызвана несколькими факторами. Увеличение выстояния глазного яблока, значительное расширение глазной щели, отсутствие ее смыкания способствуют повышению испарения слезной прекорнеальной пленки, что приводит к увеличению ее осмолярности, в результате чего происходит повреждение эпителия роговицы [12]. В работе G. Gilbard и R. Farris [12] не было обнаружено корреляции между степенью повреждения поверхности глаза и величиной экзофтальма, отставанием верхнего века, лагофтальмом, а слезопродукция у пациентов с ЭОП, по данным теста Ширмера, была в пределах нормы. По данным этого исследования, степень кератопатии зависит только от ширины глазной щели. В другом исследовании пациентов в активной стадии ЭОП было показано, что степень повреждения поверхности глаза коррелирует со снижением слезопродукции, а не экспозицией роговицы или ограничением подвижности глазного яблока кверху, что связано с вовлечением в патологический процесс слезной железы [11]. В исследовании M Brasil и соавт. [7] степень окрашивания конъюктивы бенгальским розовым достоверно коррелировала только с величиной глазной щели, достоверной связи с данными экзофтальмометрии выявлено не было. По данным исследований, были выявлены следующие модифицируемые факторы риска поражения роговицы при ЭОП: активность воспалительного процесса в орбите, величина экзофтальма, лагофтальма и глазной щели, ретракция нижнего века, увеличение степени окрашивания конъюнктивы витальными красителями и уменьшение чувствительности роговицы [3]. Кроме того, в этой работе было выявлено, что снижение экспрессии гена β-дефенсина-2, наряду с другими факторами риска, может также приводить к поражению роговицы при ЭОП. β-дефенсин-2 является эффекторной молекулой врожденного иммунитета (противомикробный пептид), которая синтезируется в эпителиальных клетках конъюнктивы и роговицы [8]. β-дефенсин-2 (HBD-2) в норме практически не продуцируется, его синтез индуцируется антигенами бактерий, вирусов, а также при нарушении целостности эпителия роговицы. Снижение чувствительности также играет важную роль в развитии патологических изменений роговицы при ЭОП. По данным А.Ф. Бровкиной, на стадии компенсации ЭОП чувствительность роговицы еще сохранена, при субкомпенсации чувствительность снижена или отсутствует, что в совокупности с другими причинами приводит к инфильтрации или язве роговицы на стадии декомпенсации. При выборе тактики местного лечения кератопатии можно руководствоваться принципами лечения нейротрофической кератопатии [19]. На первой стадии кератопатии достаточно применения любрикантов, мазей и гелей, кроме того, желательно нарушить отток слезы через нижнюю слезную точку, установив окклюдер, для повышения естественного увлажнения поверхности глаза. Задачей лечения на второй стадии является устранение эпителиального дефекта для предотвращения его прогрессирования в язву роговицы. Для этого к увлажняющим препаратам с профилактической целью добавляют местные антибактериальные препараты. Кроме того, на этой стадии требуется проведение вмешательств, приводящих к уменьшению величины глазной щели (тарзорафия, инъекции ботулотоксина А в леватор верхнего века), а также биопокрытие дефекта (амниотической мембраной, аутослизистой). Лечение на третьей стадии направлено на предотвращение лизиса стромы и профилактику перфорации. Для биопокрытия дефектов роговицы многие авторы отдают предпочтение использованию амниотической оболочки [13,17,4]. Кроме тарзорафии возможно применение цианоакрилатного клея и ношение контактных линз. При возникновении перфорации при размерах отверстия менее 2 мм возможно применение клея, однако в подавляющем большинстве случаев необходима экстренная послойная или сквозная кератопластика. Однако данные принципы лечения по отношению к лечению кератопатии при ЭОП в связи с ее многофакторностью применимы с некоторыми оговорками. Поскольку значительную роль в определении тяжести кератопатии играют величина экзофтальма, лагофтальма и ретракции век, коррекция именно этих факторов может стать решающей в лечении [10]. Поэтому принципы лечения нейротрофической кератопатии в данном случае применимы в рамках принципов хирургического лечения ЭОП. Лечение больных с патологией роговицы при ЭОП всегда должно быть комбинированным и включать этиологическое, патогенетическое и симптоматическое. Нормализация гормонального статуса является обязательным условием успеха всех вмешательств. Поражение роговицы при ЭОП можно условно разделить на 2 подтипа: первый связан с высокой активностью воспалительного процесса в орбите и его последствиями (экзофтальм, лагофтальм, хемоз, нарушение иннервации и др.); при втором варианте патология роговицы развивается на фоне фиброзных изменений в орбите вследствие ранее перенесенного активного воспаления и обусловлено остаточными явлениями, такими как экзофтальм, лагофтальм, ретракция век, снижение чувствительности и др. [3] Лечение пациентов в этих двух случаях различается. Так, при высокой активности орбитального воспаления необходимо проведение мероприятий, направленных на подавление аутоиммунного процесса, таких как назначение глюкокортикоидов в высоких дозах и, при недостаточной эффективности пульс-терапии, лучевая терапия [18]. В стадии фиброза применение этих методов лечения не приведет к улучшению, поскольку активное воспаление уже отсутствует. Слезозаместительную терапию необходимо проводить на любой стадии при наличии жалоб на жжение, покраснение, светобоязнь, а также при экзофтальме, лагофтальме и сухости глазной поверхности (по данным витального окрашивания). Дальнейшее лечение пациентов зависит от степени поражения роговицы и стадии воспалительного процесса. При поверхностной кератопатии и/или эпителиальных дефектах в активной стадии ЭОП экзофтальм и лагофтальм могут уменьшиться в результате системного применения кортикостероидов, поэтому хирургическую коррекцию этих состояний можно оставить на случай отсутствия должного ответа на консервативное лечение. В стадии фиброза целесообразно проводить исключительно хирургическое лечение, направленное на уменьшение экспозиции роговицы. При этом необходимо четко соблюдать последовательность оперативных вмешательств, поскольку результаты каждого вмешательства могут непосредственно влиять на исход последующих процедур. Общепринятой является следующая последовательность: декомпрессия орбиты, при необходимости операции на экстраокулярных мышцах и хирургические вмешательства на веках. Такой порядок вмешательств обусловлен тем, что декомпрессия орбиты приводит к изменению положения глаза и век [16,9]. Существует множество способов хирургической коррекции лагофтальма при ЭОП. Обычно применяется некровавая блефарорафия или различные методики перманентных тарзорафий. При ЭОП лагофтальм обусловлен сразу несколькими факторами, поэтому величина несмыкания век может быть значительной. Часто при этом недостаточно одного оперативного вмешательства и возникает необходимость в этапном хирургическом лечении, включая орбитальную хирургию. При невозможности проведения оперативного лечения возможно введение геля стабилизированной гиалуроновой кислоты в верхнее веко с целью уменьшения размера глазной щели и коррекции лагофтальма [2,6]. При тяжелом поражении роговицы с вовлечением стромы, выраженным экзофтальмом, лагофтальмом, хемозом и высокой активностью орбитального воспаления необходимо проводить комбинированное лечение, включающее как медикаментозные и лучевые, так и хирургические методы. В этом случае оправдано проведение хирургических вмешательств, направленных на уменьшение экзофтальма (декомпрессии орбиты), коррекцию ретракции век и лагофтальма (отсечение сухожилия ВТМ, блефаротомия, пересадка мукопериостального лоскута, тарзорафия), на защиту роговицы (биопокрытие). Таким образом, лечение пациентов с поражением роговицы при ЭОП может быть различным, зачастую комбинированным, с учетом множества факторов. Выбор лечебных мероприятий зависит, прежде всего, от активности орбитального воспаления, величины экзофтальма и степени выраженности изменений роговицы. Хирургическая составляющая лечения может включать в себя проведение декомпрессии орбиты, коррекцию лагофтальма и ретракции век, биопокрытие роговицы, коррекцию косоглазия и другие вмешательства. Список литературы 1. Бровкина А.Ф. Эндокринная офтальмопатия. М.: Геотар-Медиа, 2004, 174 с. 2. Груша Я.О., Исмаилова Д.С., Иванченко Ю.Ф., Агафонова Е.И. Первый опыт применения препарата стабилизированной гиалуроновой кислоты для коррекции лагофтальма. Вестник офтальмологии 2010; 126 (1): 39-42. 3. Груша Я.О., Исмаилова Д.С., Ганковская О.А. Факторы риска поражения роговицы у больных с эндокринной офтальмопатией. Вестник офтальмологии 2010; 126 (6): 35-38. 4. Груша Я.О., Каспаров А.А., Киселева Т.Н., Федоров А.А., Филимонов Г.П., Зайцев А.В., Полунина А.А., Исмаилова Д.С. Комбинированное хирургическое лечение язвы роговицы при эндокринной офтальмопатии. Вестник офтальмологии 2008; 124 (6): 57-59. 5. Груша Я.О., Федоров А.А., Исмаилова Д.С. Mорфологические изменения конъюнктивы при эндокринной офтальмопатии. Вестник офтальмологии 2011; 127 (2): 31-35. 6. Груша Я.О., Федоров А.А., Шептулин В.А. Инъекционные имплантаты на основе геля гиалуроновой кислоты при патологии придаточного аппарата глаза. М.: Геотар-Медиа, 2017, 112 с. 7. Brasil M.V., Brasil O.F., Vieira R.P., Vaisman M., Amaral Filho O.M. Tear film analysis and its relation with palpebral fissure height and exophthalmos in Graves' ophthalmopathy. Arq Bras Oftalmol. 2005; 68 (5): 615-8. 8. Chaly Y.V., Paleolog E.M., Kolesnikova T.S., Tikhonov I.I., Petratchenko E.V., Voitenok N.N. Human neutrophil α-defensin modulates cytokine production in human monocytes and adhesion molecules expression in endothelial cells. Eur Cytokine Netw. 2000; 11: 257-266. 9. Cho R.I., Elner V.M., Nelson C.C., Frueh B.R. The effect of orbital decompression surgery on lid retraction in thyroid eye disease. Ophthal Plast Reconstr Surg. 2011; 27 (6):436-8. 10. Della Rocca R. Thyroid-related orbithopathy: concepts and management. Facial Plast Surg. 2007: 23: 168-173. 11. Eckstein A.K., Finkenrath A., Heiligenhaus A., Renzing-Kohler K., Esser J., Krüger C., Quadbeck B., Steuhl K.P., Gieseler R.K. Dry eye syndrome in thyroid-associated ophthalmopathy: lacrimal expression of TSH receptor-specific autoantibodies. Acta Ophthalmol Scand. 2004; 82: 291-297. 12. Gilbard G.P., Farris R.L. Ocular surface drying and tear film osmolarity in thyroid eye disease. Acta ophthalmol. 1983; 61 (1): 108-116. 13. Heinz C., Eckstein A., Steuhl K.P., Meller D. Amniotic membrane transplantation for reconstruction of corneal ulcer in graves ophthalmopathy. Cornea 2004; 23(5): 524-6. 14. Ismailova D.S., Fedorov A.A., Grusha Y.O. Ocular surface changes in thyroid eye disease. Orbit 2013; 32 (2): 87-90. 15. Nowak M., Marek B. Kos-Kudła B, Kajdaniuk D, Siemińska L. Tear film profile in patients with active thyroid orbithopathy. Klin Oczna. 2005; 107: 479-82. 16. Rajabi M.T., Jafari H., Mazloumi M., Tabatabaie S.Z., Rajabi M.B., Hasanlou N., Abtahi S.M., Goldberg R.A. Lower lid retraction in thyroid orbitopathy: lamellar shortening or proptosis? Int Ophthalmol. 2014; 34(4):801-4. 17. Solomon A., Meller D., Prabhasawat P., John T., Espana E.M., Steuhl K.P., Tseng S.C. Amniotic membrane grafts for nontraumatic corneal perforations, descemetoceles, and deep ulcers. Ophthalmology 2002; 109 (4): 694-703. 18. Verity D.H., Rose G.E. Acute thyroid eye disease (TED): principles of medical and surgical management. Eye (Lond.) 2013; 27 (3): 308-19. 19. Wells J.R., Michelson M.A. Diagnosing and Treating Neurotrophic keratopathy. Ophthalmic Pearls. Available at: www.aao.org
Corresponding author: Ismailova Dilyara; е-mail: d_ismailova@bk.ru. Funding: The study had no sponsorship. Conflict of interest: None declared. Abstract A severe case of corneal damage in patient with thyroid eye disease (TED) is presented. Surgical interventions and medication treatment performed on different disease stages are described. Complex treatment resulted in long-term stabilization and remission of TED. Brief review of literature deals with the problems of etiology, pathogenesis, risk factors and treatment of keratopathy associated with thyroid eye diseases. Treatment of corneal damage in patients with TED may be different and often complex, taking into consideration many factors. The choice of treatment depends on severity of corneal damage and orbital inflammation activity. Surgical treatment may include orbital decompression, lagophthalmos and eyelid retraction correction, corneal and squint surgery. Key words thyroid eye disease, corneal ulcer, dry eye syndrome, eyelid retraction, lagophthalmos, orbital decompression, pulse therapy, tarsorhaphy References 1. Brovkina A.F. Endokrinnaya oftal'mopatiya [Thyroid eye disease]. Moscow: Geotar-media, 2004. (In Russ.) 2. Grusha Ia.O., Ismailova D.S., Ivanchenko Ju.F., Agafonova E.I. Pervyj opyt primeneniya preparata stabilizirovannoj gialuronovoj kisloty dlya korrekcii lagoftal'ma [The first experience in using the stabilized hyaluronic acid preparation to correct lagophthalmos]. Vestn Oftalmol. [Russian Annals of Ophtalmology] 2010; 126 (1): 39-42. (In Russ.) 3. Grusha Ia.O., Ismailova D.S., Gankovskaia O.A. Faktory riska porazheniya rogovicy u bol'nyh s ehndokrinnoj oftal'mopatiej [Risk factors of corneal damage in patients with Thyroid Eye Disease]. Vestn Oftalmol. [Russian Annals of Ophtalmology] 2010;126(6):35-38 (In Russ.) 4. Grusha Ia.O., Kasparov A.A., Kiseleva T.N., Fedorov A.A., Filimonov G.P., Zaitsev A.V., Polunina A.A., Ismailova D.S. Kombinirovannoe hirurgicheskoe lechenie yazvy rogovicy pri ehndokrinnoj oftal'mopatii [Combined surgical treatment for corneal ulcer in endocrine ophthalmopathy]. Vestn Oftalmol. [Russian Annals of Ophtalmology] 2008; 124(6): 57-59 (In Russ.) 5. Grusha Ia.O., Fedorov A.A., Ismailova D.S. Morfologicheskie izmeneniya kon"yunktivy pri ehndokrinnoj oftal'mopatii [Morphology of conjunctival changes in thyroid eye disease]. Vestn Oftalmol. [Russian Annals of Ophtalmology] 2011; 127 (2): 31-35 (In Russ.) 6. Grusha Y.O., Fedorov A.A., Sheptulin V.A. In"ekcionnye implantaty na osnove gelya gialuronovoj kisloty pri patologii pridatochnogo apparata glaza [Injectable hyaluronic acid gel implants in adnexal diseases]. Moscow: Geotar-media, 2017. (In Russ.) 7. Brasil M.V., Brasil O.F., Vieira R.P., Vaisman M., Amaral Filho O.M. Tear film analysis and its relation with palpebral fissure height and exophthalmos in Graves' ophthalmopathy. Arq Bras Oftalmol. 2005; 68(5): 615-8. 8. Chaly Y.V., Paleolog E.M., Kolesnikova T.S., Tikhonov I.I., Petratchenko E.V., Voitenok N.N. Human neutrophil α-defensin modulates cytokine production in human monocytes and adhesion molecules expression in endothelial cells. Eur Cytokine Netw. 2000; 11: 257-266. 9. Cho R.I., Elner V.M., Nelson C.C., Frueh B.R. The effect of orbital decompression surgery on lid retraction in thyroid eye disease. Ophthal Plast Reconstr Surg. 2011; 27 (6): 436-8. 10. Della Rocca R. Thyroid-related orbithopathy: concepts and management. Facial Plast Surg. 2007: 23: 168-173. 11. Eckstein A.K., Finkenrath A., Heiligenhaus A., Renzing-Kohler K., Esser J., Krüger C., Quadbeck B., Steuhl K.P., Gieseler R.K. Dry eye syndrome in thyroid-associated ophthalmopathy: lacrimal expression of TSH receptor-specific autoantibodies. Acta Ophthalmol Scand. 2004; 82: 291-297. 12. Gilbard G.P., Farris R.L. Ocular surface drying and tear film osmolarity in thyroid eye disease. Acta ophthalmol. 1983; 61 (1): 108-116. 13. Heinz C., Eckstein A., Steuhl K.P., Meller D. Amniotic membrane transplantation for reconstruction of corneal ulcer in graves ophthalmopathy. Cornea. 2004; 23(5): 524-6. 14. Ismailova D.S., Fedorov A.A., Grusha Y.O. Ocular surface changes in thyroid eye disease. Orbit. 2013; 32 (2): 87-90. 15. Nowak M., Marek B. Kos-Kudła B, Kajdaniuk D, Siemińska L. Tear film profile in patients with active thyroid orbithopathy. Klin Oczna 2005; 107: 479-82. 16. Rajabi M.T., Jafari H., Mazloumi M., Tabatabaie S.Z., Rajabi M.B., Hasanlou N., Abtahi S.M., Goldberg R.A. Lower lid retraction in thyroid orbitopathy: lamellar shortening or proptosis? Int Ophthalmol. 2014; 34 (4) :801-4. 17. Solomon A., Meller D., Prabhasawat P., John T., Espana E.M., Steuhl K.P., Tseng S.C. Amniotic membrane grafts for nontraumatic corneal perforations, descemetoceles, and deep ulcers. Ophthalmology 2002; 109 (4): 694-703. 18. Verity D.H., Rose G.E. Acute thyroid eye disease (TED): principles of medical and surgical management. Eye (Lond.) 2013; 27 (3): 308-19. 19. Wells J.R., Michelson M.A. Diagnosing and Treating Neurotrophic keratopathy. Ophthalmic Pearls. Available at: www.aao.org |
[ См. также ] Рубрики |
||||
|
|
|
Журнал «Медицина» © ООО "Инновационные социальные проекты"
|