| О журнале | Редколлегия | Редсовет | Архив номеров | Поиск | Авторам | Рецензентам | English |
Влияние вальпразоламида на содержание нейроактивных аминокислот в головном мозге крыс
Автор для корреспонденции: Малыгин Александр Сергеевич; e-mail: dr.a.s.m@yandex.ru. Финансирование. Исследование не имело спонсорской поддержки. Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов. Аннотация В экспериментах на крысах исследовано влияние вальпразоламида – нового противоэпилептического средства из группы амидных производных вальпроевой кислоты на содержание нейроактивных аминокислот (ГАМК, глицина, глутаминовой и аспарагиновой кислот) в головном мозге. Определение аминокислот осуществляли методом хромато-масс-спектрометрии. Показано, что при однократном внутрибрюшинном введении вальпразоламид (100 мг/кг) увеличивает уровень ГАМК и амидной формы глутаминовой кислоты, уменьшает содержание аспарагина, глутаминовой и аспарагиновой кислот в головном мозге крыс. Ключевые слова вальпроаты, противоэпилептические средства, γ-аминомасляная кислота, глицин, аспарагиновая кислота, глутаминовая кислота doi: 10.29234/2308-9113-2019-7-1-99-108 Введение Одними из наиболее часто используемых антиконвульсантов являются производные вальпроевой кислоты. Вальпроаты эффективны в лечении эпилепсии различных форм (большие и малые приступы, миоклоническая, тонико-клоническая и биполярная формы) и других заболеваний ЦНС, сопровождающихся эпилептическим синдромом [5,9]. Они оказывают также противоопухолевое, антиретровирусное, нейропротекторное действие, уменьшают выраженность нейропатической боли. Механизм действия вальпроатов сложен и до конца не изучен. Известно, что вальпроевая кислота повышает концентрацию ГАМК в тканях головного мозга, активируя глутаматдекарбоксилазу (фермент, участвующий в синтезе ГАМК) и угнетая ГАМК-транферазу (фермент, разрушающий ГАМК) [7,8,9]. Вальпроевая кислота может блокировать низковольтажные кальциевые каналы Т-типа аналогично действию этосуксимида, а также потенциалзависимые натриевые каналы по механизму, схожему с фенитоином и карбамазепином [5]. Механизм противоопухолевого действия вальпроевой кислоты связывают с ее способностью угнетать активность гистон-деацетилаз, активирующих пролиферацию клеток и тормозящих их дифференцировку [5,9]. Новым противоэпилептическим средством из группы амидных производных вальпроевой кислоты является вальпразоламид (N-(5-Этил-1,3,4-тиадиазол-2-ил)-2-пропилпентанамид). В экспериментах на животных с использованием различных моделей эпилепсии вальпразоламид продемонстрировал высокую противоэпилептическую активность в сочетании с низкой токсичностью [3]. Для выяснения механизма противоэпилептической активности особый интерес представляет экспериментальное исследование его влияния на содержание ГАМК и других нейроактивных аминокислот в головном мозге. Цель исследования Целью настоящего исследования явилась исследование влияния вальпразоламида на содержание тормозных и возбуждающих аминокислот в головном мозге крыс. Материалы и методы исследования Экспериментальные исследования выполнены с использованием белых аутбредных крыс-самцов Wistar массой 190-210 г. Животных содержали при постоянной температуре (22±2°C) и искусственном 12-часовом режиме дня и ночи (светлое время 08:00-20:00) со свободным доступом к воде и пище. Условия содержания подопытных животных соответствовали правилам лабораторной практики при проведении доклинических исследований в РФ [4]. Все эксперименты осуществляли в соответствии с методическими рекомендациями по проведению доклинических исследований лекарственных средств [2] с соблюдением "Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях" (Directive 2010/63/EU) при наличии разрешения этического комитета Тверского государственного медицинского университета. Вальпразоламид вводили подопытным крысам внутрибрюшинно в дозе 100 мг/кг (терапевтическая доза для противоэпилептической активности при судорогах, индуцированных пентилентетразолом и максимальным электрошоком). Животные группы контроля получали изотонический раствор натрия хлорида. Декапитацию крыс проводили через 40 мин после введения исследуемого лекарственного средства. Забор крови осуществляли в обработанные натриевой солью гепарина пробирки в объеме 0,5 мл. Головной мозг и его структуры (фронтальную кору и гиппокамп) извлекали на льду, замораживали в жидком азоте и сохраняли в криопробирках при –80°С. В процессе пробоподготовки головной мозг и его структуры (гиппокамп, фронтальную кору головного мозга) гомогенизировали с метанолом, добавляя в качестве внутреннего стандарта L-норвалин (0,8 мкмоль/мл), используя стеклянный гомогенизатор Поттера. Гомогенизат мозговой ткани центрифугировали при 12000 об/мин. в течение 10 минут при температуре 4оС. К 500 мкл супернатанта добавляли 500 мкл гексана, пробы встряхивали на вортекс-шейкере в течение 3-х мин и центрифугировали для разделения фаз. Из водной фазы отбирали 100 мкл, добавляли 900 мкл 0,1 н HCl, встряхивали на вортекс-шейкере, после чего к 100 мкл полученного экстракта добавляли 900 мкл 0,1 н HCl и встряхивали на вортекс-шейкере. Полученные гомогенаты мозговой ткани использовали для биохимических исследований. Количественное определение содержания вальпразоламида [1], тормозных (γ-аминомасляной кислоты, глицина) и возбуждающих (глутаминовой и аспарагиновой кислот и их амидов) аминокислот в гомогенатах головного мозга крыс осуществляли хромато-масс-спектрометрическим методом (ВЭЖХ-МС/МС). Методика была валидирована по параметрам селективности, точности, прецизионности, линейности, стабильности (EMA 2010). Хроматографический анализ биологических образцов осуществляли с помощью высокоэффективного жидкостного хроматографа Agilent 1260 Infinity II (Agilent Technologies, ФРГ) с аналитической колонкой Eclipse ААA 3,5 мкм 3×150 мм при температуре 40оС. Хроматографию проводили в градиентном режиме: 0-2 мин – смесь ацетонитрила и воды деионизированной в соотношении 5:95 с добавлением 0,1% муравьиной кислоты; 2-6 мин – увеличение концентрации ацетонитрила до 70%, 6-7 мин – фаза плато (70% ацетонитрил), 7-10 мин – ацетонитрил и вода деионизированная в соотношении 5:95. Скорость потока подвижной фазы – 0,4 мл/мин; объем вводимой пробы – 5 мкл; общее время градиентного элюирования – 10 минут. Определение аминокислот в биологических образцах осуществляли без предшествующей дериватизации. Детекцию нейроаминокислот осуществляли масс-спектрометрически. В качестве детектора использовали тройной квадрупольный масс-спектрометр AB Sciex QTrap 3200 MD (AB Sciex, Сингапур) с электрораспылительным источником ионов (Turbo V с зондом TurboIonSpray). Результаты исследований обрабатывали статистически с применением программного обеспечения "AnalystSoft Inc., BioStat – программа статистического анализа. Версия 2009". Анализ вида распределения количественных признаков и проверку равенства дисперсий проводили с использованием критерия Шапиро-Уилка. Для оценки достоверности различий выборок, имеющих нормальное распределение, применяли параметрический t-критерий Стьюдента, в случае ненормального распределения использовали U-тест Манна-Уитни. За достоверное принимали различие при уровне вероятности 95% и более (p<0,05). Результаты исследования и их обсуждение На начальном этапе экспериментального исследования подбирали оптимальные параметры для хромато-масс-спектрометрического определения тормозных (γ-аминомасляной кислоты и глицина) и возбуждающих (глутаминовой и аспарагиновой кислот и их амидов) аминокислот в гомогенатах головного мозга крыс. Для каждого аналита определяли время удерживания для используемого режима градиентного элюирования. На рисунках 1-3 показаны нейроаминокислоты на хроматограммах гомогенатов головного мозга крыс. Рис. 1. γ-Аминомасляная кислота (А) и глицин (Б) на хроматограмме гомогената головного мозга крыс. 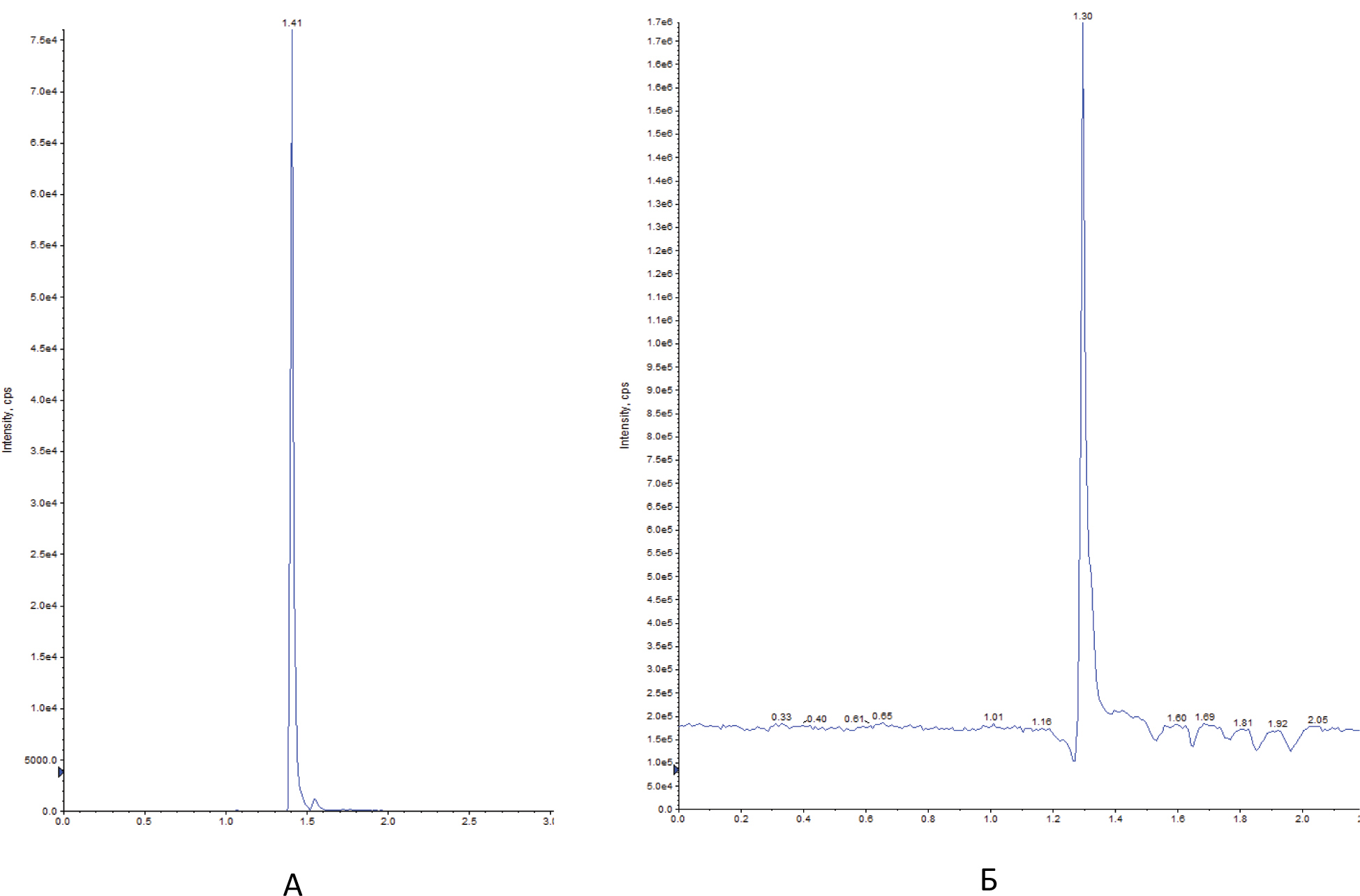 Рис. 2. L-аспарагин (А) и L-аспарагиновая кислота (Б) на хроматограмме гомогената головного мозга крыс. 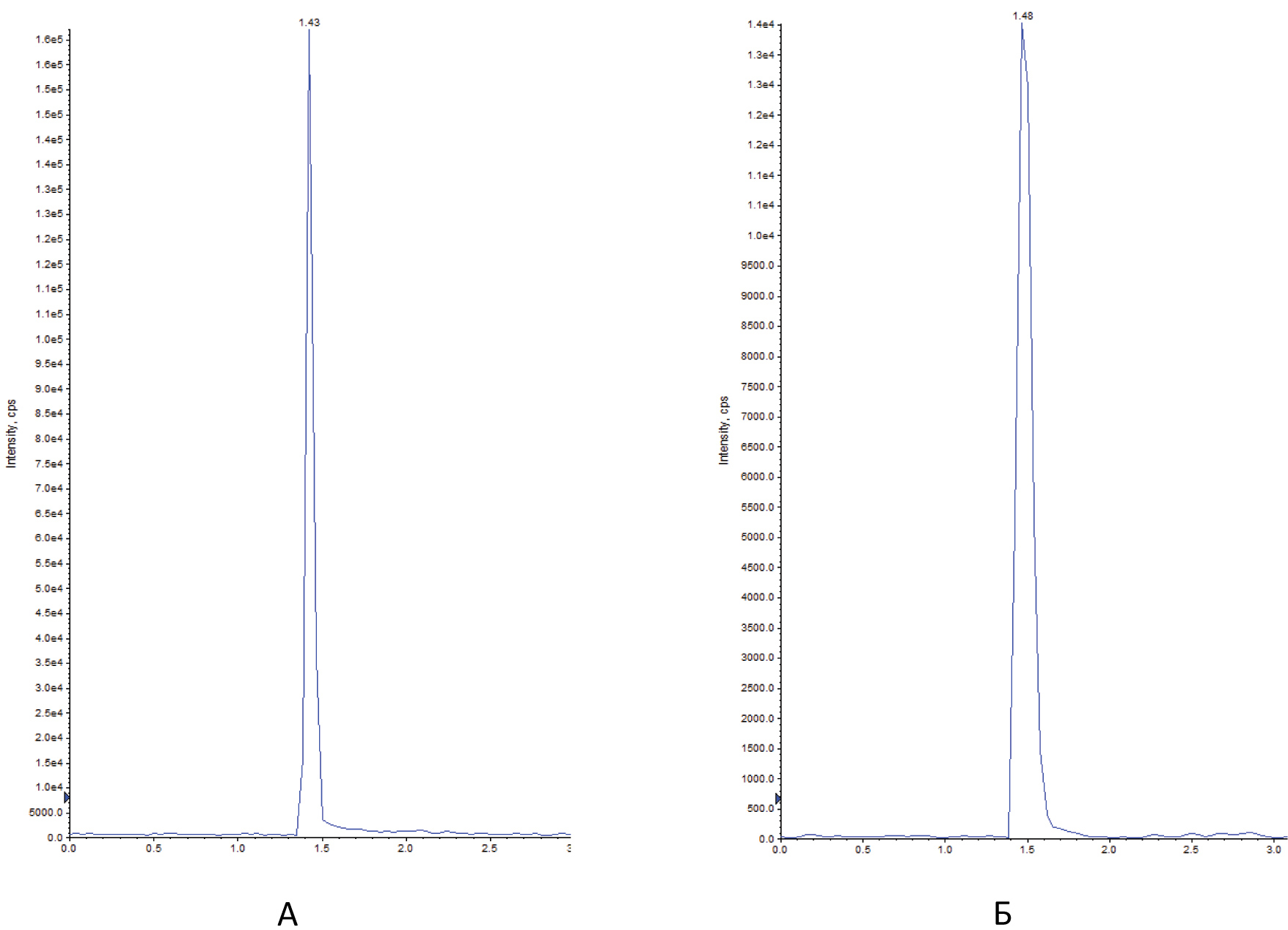 Рис. 3. L-глутамин (А) и L-глутаминовая кислота (Б) на хроматограмме гомогената головного мозга крыс. 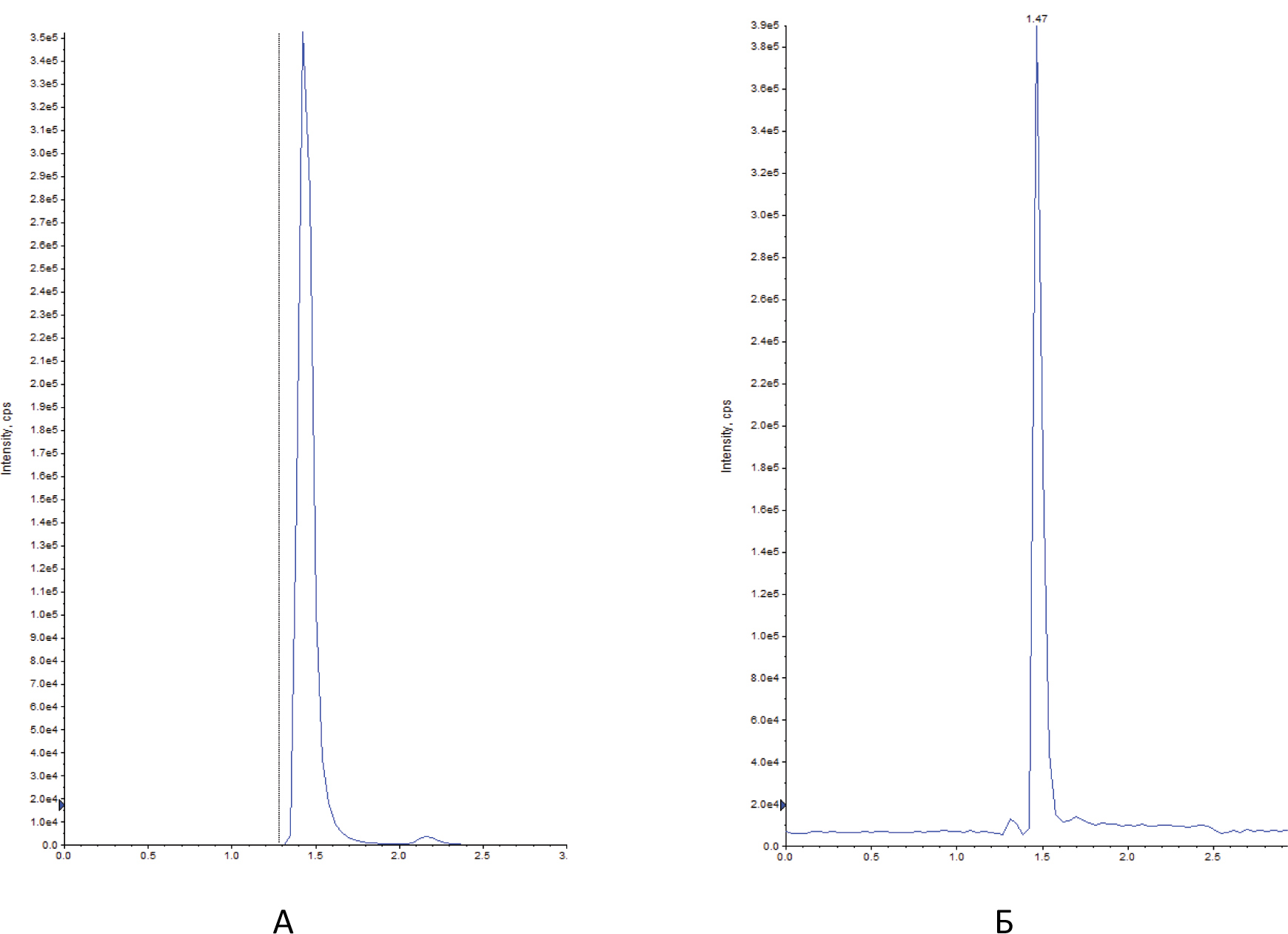 Детекцию аминокислот осуществляли масс-спектрометрически. Для каждого аналита подбирали оптимальное значение энергии столкновения. Идентификацию глицина осуществляли при положительной ионизации ([M+H]+) в режиме селективного ионного мониторинга (SIM) по значению m/z 76. Для масс-спектрометрической идентификации остальных аминокислот использовали режим мониторинга множественных реакций (MRM) при положительной ионизации. Значения MRM составили для γ-аминомасляной кислоты, L-аспарагиновой кислоты, L-аспарагина, L-глутаминовой кислоты, L-глутамина соответственно m/z 104 →m/z 87 и m/z 45; m/z 134,1 →m/z 74; m/z 133,1→m/z 74,1; m/z 148,1 →m/z 84; m/z147,1→m/z 84,1. Хромато-масс-спектрометрические параметры нейроаминокислот приведены в таблице 1. Таблица 1. Хромато-масс спектрометрические параметры нейроактивных аминокислот 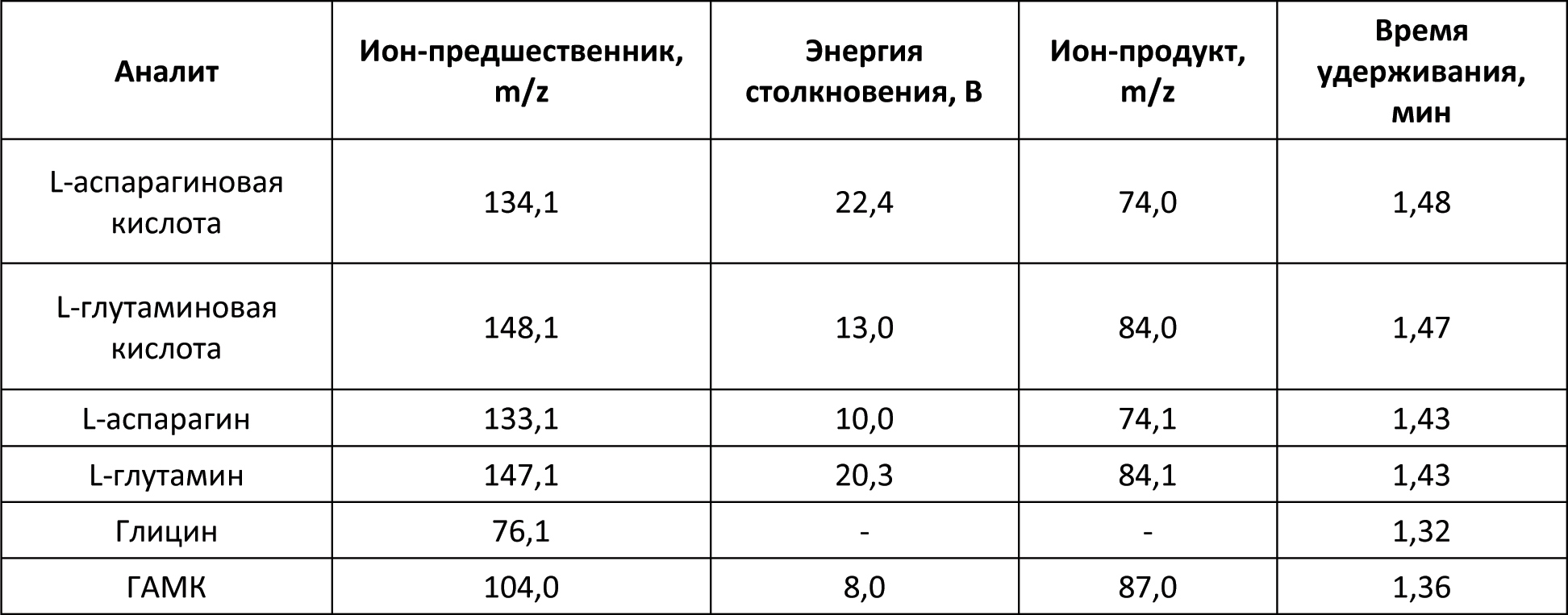 Нижние пределы идентификации и количественного определения нейроактивных аминокислот определяли по соотношению сигнал/шум соответственно 1:3 и 1:10 (табл. 2). Таблица 2. Нижние пределы идентификации и количественного определения нейроактивных аминокислот в гомогенатах головного мозга крыс хромато-масс-спектрометрическим методом 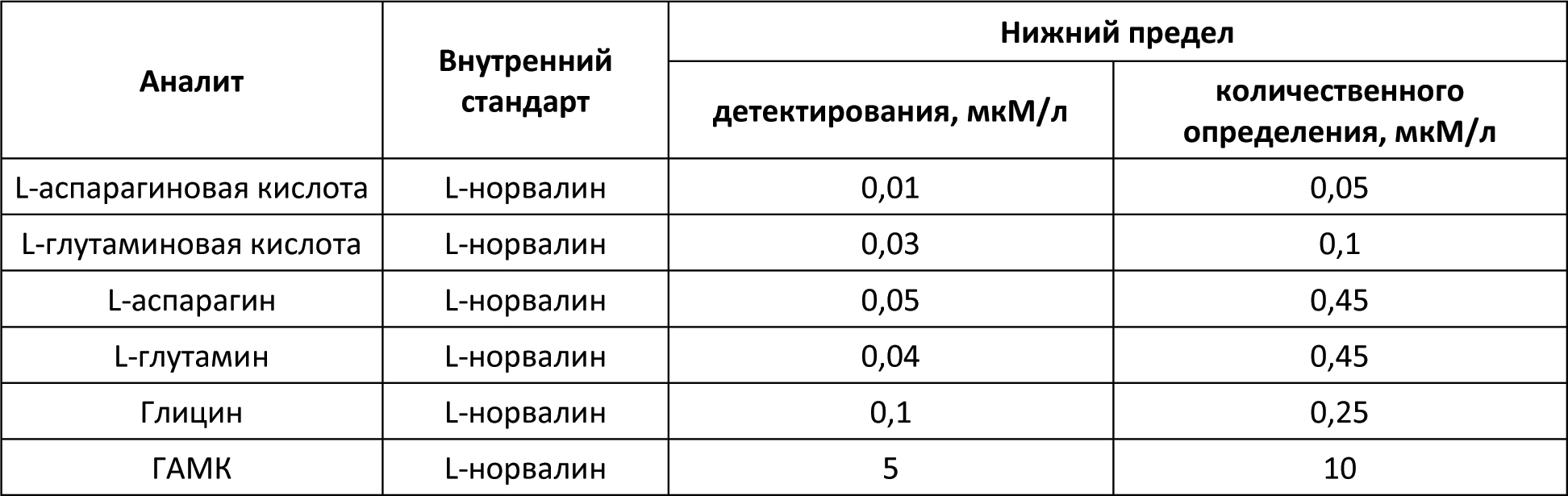 Диапазоны линейности, уравнения регрессии и значения коэффициента корреляции для хромато-масс-спектрометрического метода определения γ-аминомасляной кислоты, глицина, глутаминовой и аспарагиновой кислот и их амидов в гомогенатах головного мозга крыс приведены в таблице 3. Таблица 3. Уравнение регрессии, коэффициент корреляции и линейный диапазон при хромато-масс-спектрометрическом определении нейроактивных аминокислот в головном мозге крыс 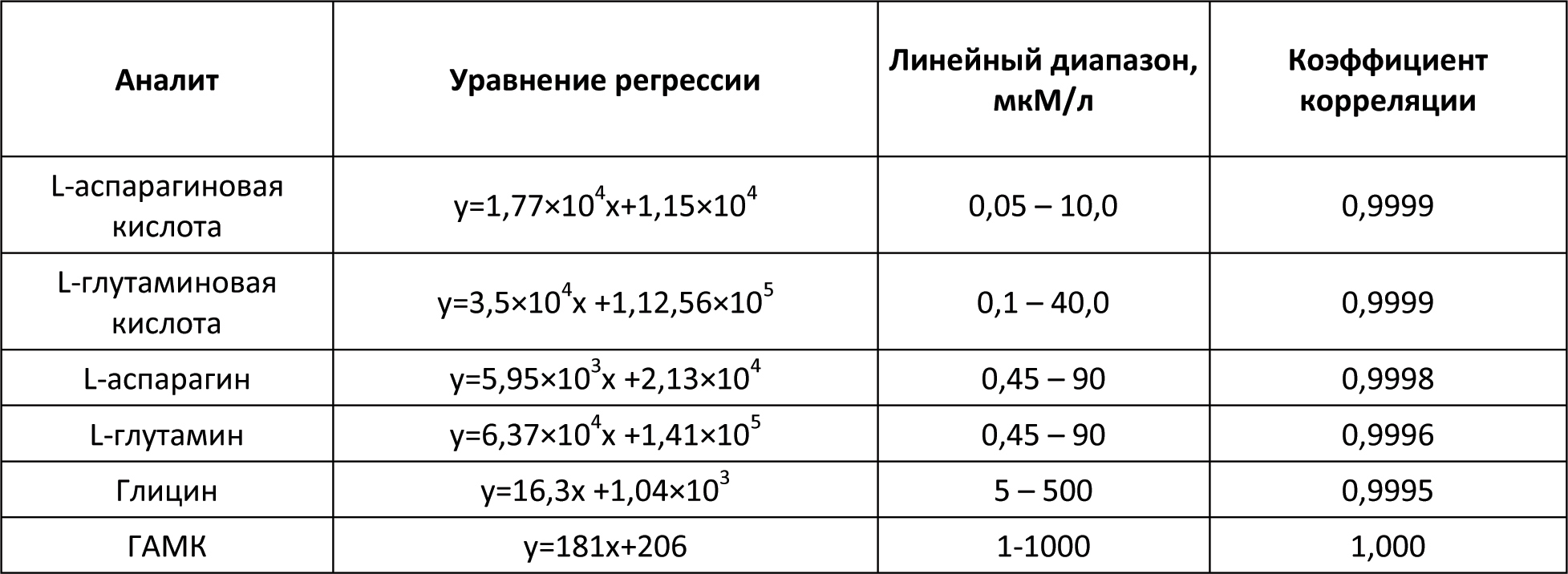 Анализ результатов проведенного экспериментального исследования показал, что вальпразоламид, обладая высокой липофильностью, хорошо проникает через гематоэнцефалический барьер. Через 40 минут после внутрибрюшинного введения в дозе 100 мг/кг его содержание в головном мозге подопытных крыс составило 1167,6±39,4 мкг/г, а концентрация в плазме крови – 242,0±29,1 мкг/мл. Одновременно в головном мозге подопытных крыс, получавших вальпразоламид, было выявлено изменение содержания нейроактивных аминокислот по сравнения с их уровнем у животных группы контроля, получавших изотонический раствор натрия хлорида. Наиболее существенные изменения уровня нейроаминокислот были выявлены в гиппокампе и во фронтальной коре подопытных животных (табл. 4). Таблица 4. Содержание аминокислот (Мean±S.E.M.) в гиппокампе и фронтальной коре головного мозга крыс при внутрибрюшинном введении вальпразоламида (100 мг/кг) 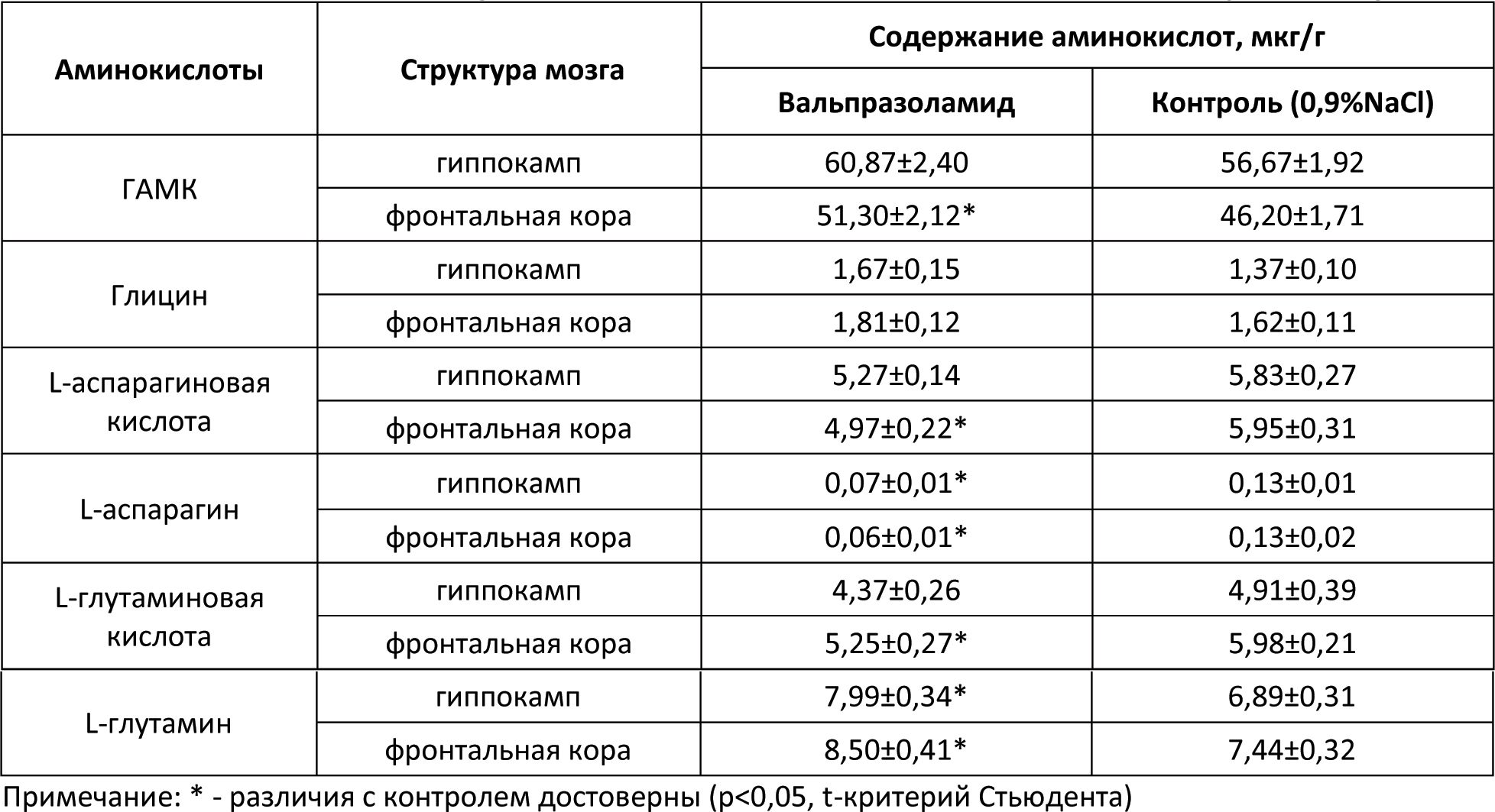 Отмечено, что у интактных животных содержание ГАМК в гиппокампе было в среднем на 22,7% выше (р<0,05), чем во фронтальной коре. В серии опытов с введением вальпразоламида (100 мг/кг) было обнаружено увеличение уровня этой аминокислоты в головном мозге, преимущественно во фронтальной коре в среднем на 11% (р<0,05). Достоверных изменений содержания глицина под влиянием вальпразоламида отмечено не было. Уровень глутаминовой кислоты снизился в среднем на 12,2% во фронтальной коре, в гиппокампе отмечена лишь тенденция к снижению уровня данной аминокислоты. Обращает на себя внимание тот факт, что содержание глутамина (амидной формы глутаминовой кислоты, которая образуется в глиальных клетках после захвата глутаминовой кислоты из синаптической щели) под влиянием вальпразоламида напротив увеличилось соответственно на 15,9% (р<0,05) и 14,2% (р<0,05) в гиппокампе и во фронтальной коре. Одновременно обнаружено снижение уровня аспарагиновой кислоты во фронтальной коре в среднем на 16,5% (р<0,05) и ее амидной формы в среднем в 2 раза (р<0,05) во фронтальной коре и гиппокампе. Выводы Таким образом, вальпразоламид – новое противоэпилептическое средство из группы амидных производных вальпроевой кислоты, являясь липофильным соединением, хорошо проникает через гематоэнцефалический барьер и вызывает выраженные изменения содержания нейроактивных аминокислот. При однократном внутрибрюшинном введении интактным крысам в дозе 100 мг/кг отмечалось характерное для вальпроатов увеличение уровня ГАМК во фронтальной коре головного мозга, снижение уровня возбуждающих нейроаминокислот – аспарагиновой и глутаминовой кислот во фронтальной коре и увеличение уровня амидной формы глутаминовой кислоты в гиппокампе и во фронтальной коре. Список литературы 1. Малыгин А.С., Попов Н.С., Демидова М.А. Экспериментальное исследование особенностей метаболизма вальпразоламида. Верхневолжский медицинский журнал 2018; 17(4): 3-8. 2. Миронов А.Н. Руководство по проведению доклинических исследований лекарственных средств. М.: Гриф и К., 2012. 944 с. 3. Пат. 2651572 Российская Федерация, МПК А 61 К 31/433 N-(5-Этил-1,3,4-тиадиазол-2-ил)-2-пропилпентанамид, обладающий противоэпилептической и обезболивающей активностями / С.Я. Скачилова, А.С.Малыгин, Н.С.Попов [и др.]; заявитель и патентообладатель ОАО ВНЦ БАВ. – № 267288; заявл. 13.03.2018; опубл. 20.11.2018, Бюл. № 32. – 1 с. 4. Приказ МЗ РФ от 01.04.2016 № 199н "Правила надлежащей лабораторной практики". 5. Фрейдкова Н.В., Пылаева О.В., Мухин К.Ю. Вальпарин ХР в лечении эпилепсии (обзор литературы и описание клинических случаев). Русский журнал детской неврологии 2015; 10(3): 37-42. 6. Шнайдер Н.А. Дмитренко Д.В. Хроническая интоксикация вальпроевой кислотой в эпилептологии: диагностика и лечение. Неврология, нейропсихиатрия, психосоматика 2016; 8(2): 94-99. 7. Bertelsen F., Landau AM., Vase KH., Jacobsen J. et al. Acute in vivo effect of valproic acid on the GABAergic system in rat brain: A [11C]Ro15-4513 microPET study. Brain Res. 2018 Feb 1; 1680:110-114. 8. Göttlicher M., Minucci S., Zhu P., Krämer O. et al. Valproic acid defines a novel class of HDAC inhibitors inducing differentiation of transformed cells. The EMBO Journal 2001; 20 (24): 6969-6978. 9. Perucca E. Pharmacological and therapeutic properties of valproate: a summary after 35 years of clinical experience. CNS Drugs 2012; 16 (10): 695-714. 10. Piplani S, Verma PK, Kumar A. Neuroinformatics analyses reveal GABAt and SSADH as major proteins involved in anticonvulsant activity of valproic acid. Biomed Pharmacother. 2016; 81: 402-410.
Corresponding Author: Malygin Aleksandr; e-mail: dr.a.s.m@yandex.ru. Conflict of interest. None declared. Funding. The study had no sponsorship. Abstract In experiments on rats, the effect of valprazolamide, a new antiepileptic agent from the group of amide derivatives of valproic acid, on the brain content of neuroactive amino acids (GABA, glycine, glutamic and aspartic acids) was studied. Detection of amino acids was performed by gas chromatography-mass spectrometry. It was shown that a single intraperitoneal injection of valprazolamide (100 mg / kg) increases the level of GABA and the amide form of glutamic acid, reduces the levels of asparagine, glutamic and aspartic acids in the rat brain. Key words valproates, antiepileptics, γ-aminobutyric acid, glycine, aspartic acid, glutamic acid References 1. Malygin A.S., Popov N.S., Demidova M.A. Eksperimental'noe issledovanie osobennostej metabolizma val'prazolamida [An experimental study of the metabolism of valprazolamide]. Verhnevolzhskij medicinskij zhurnal [Upper Volga Medical Journal] 2018; 17(4): 3-8. (In Russ.) 2. Mironov A.N. Rukovodstvo po provedeniyu doklinicheskih issledovanij lekarstvennyh sredstv [Manual for preclinical studies of pharmaceutical drugs]. Moscow: Grif i K., 2012. (In Russ.) 3. Pat. 2651572 Rossijskaya Federaciya, MPK A 61 K 31/433 N-(5-EHtil-1,3,4-tiadiazol-2-il)-2-propilpentanamid, obladayushchij protivoehpilepticheskoj i obezbolivayushchej aktivnostyami [Russian Federation Patent MPK A 61 K 31/433 H- (5-Ethyl-1,3,4-thiadiazol-2-yl) -2-propylpentanamide antiepileptic and analgesic activities]/ S.Ya. Skachilova, A.S.Malygin, N.S.Popov et al.; zayavitel' i patentoobladatel' OAO VNC BAV [Patent holder OAO VNC BAV]. – № 267288; decl. 13.03.2018; publ. 20.11.2018, Bull. № 32. (In Russ.) 4. Prikaz MZ RF ot 01.04.2016 № 199n "Pravila nadlezhashchej laboratornoj praktiki" [Ministry of Health Order of 01.04.2016 № 199n "On Good Laboratory Practice Rules"]. (In Russ.) 5. Frejdkova N.V., Pylaeva O.V., Muhin K.Yu. Val'parin HR v lechenii ehpilepsii (obzor literatury i opisanie klinicheskih sluchaev) [Valparin XP in the treatment of epilepsy (review of the literature and description of clinical cases)]. Russkij zhurnal detskoj nevrologii [Russian Journal of Pediatric Neurology] 2015; 10(3): 37-42. (In Russ.) 6. Shnajder N.A. Dmitrenko D.V. Hronicheskaya intoksikaciya val'proevoj kislotoj v ehpileptologii: diagnostika i lechenie [Chronic intoxication with valproic acid in epileptology: diagnosis and treatment]. Nevrologiya, nejropsihiatriya, psihosomatika [Neurology, neuropsychiatry, psychosomatics] 2016; 8(2): 94-99. (In Russ.) 7. Bertelsen F., Landau AM., Vase KH., Jacobsen J. et al. Acute in vivo effect of valproic acid on the GABAergic system in rat brain: A [11C]Ro15-4513 microPET study. Brain Res. 2018 Feb 1; 1680:110-114. 8. Göttlicher M., Minucci S., Zhu P., Krämer O. et al Valproic acid defines a novel class of HDAC inhibitors inducing differentiation of transformed cells. The EMBO Journal 2001; 20 (24): 6969-6978. 9. Perucca E. Pharmacological and therapeutic properties of valproate: a summary after 35 years of clinical experience. CNS Drugs 2012; 16 (10): 695-714. 10. Piplani S, Verma PK, Kumar A. Neuroinformatics analyses reveal GABAt and SSADH as major proteins involved in anticonvulsant activity of valproic acid. Biomed Pharmacother. 2016; 81: 402-410. |
[ См. также ] Рубрики |
||||
|
|
|
Журнал «Медицина» © ООО "Инновационные социальные проекты"
|